Новые препараты 2020 года в медицине
Обзор 18 новейших антибактериальных препаратов в мировой практике
Одним из величайших достижений медицинской науки XX в. является открытие и внедрение в клиническую практику антибиотиков, «победа над микроорганизмами при помощи их же оружия». Однако, фактически использование антибактериальных средств вылилось в затяжное противостояние между человечеством и микромиром. Бесконтрольное увлечение антибиотиками, от применения в животноводстве для быстрого набора веса скотом до бытового «поедания» этих препаратов при любом насморке, способствует распространению полирезистентных штаммов бактерий. Несмотря на умение микроорганизмов приспосабливаться к препаратам, ученые не опускают рук. С 2010 года по сегодняшний день в клиническую практику введено 18 новых антибактериальных препаратов и их комбинаций (некоторые — только в стране-производителе). Один из этих препаратов разработан и используется в РФ, а еще семь — зарегистрированы для использования в нашей стране.
Цефтазидим/авибактам, одобрен Управлением по контролю за продуктами и лекарствами США (FDA; Food and Drug Administration) в 2015 г., в РФ зарегистрирован с мая 2017 г.
Цефтазидим, цефалоспорин III поколения — препарат широкого спектра, нарушает формирование клеточной стенки бактерий через пенициллинсвязывающие белки и индуцирует ее повреждение путем активации аутолитических ферментов. Основное значение имеет активность этого антибиотика против таких грамотрицательных микроорганизмов, как
 Новый антибиотик решает эту проблему при помощи ингибитора β-лактамаз авибактама, восстанавливающего чувствительность к цефтазидиму. Авибактам инактивирует β-лактамазы класса А (в том числе карбопенемазы Klebsiella pneumoneae
Новый антибиотик решает эту проблему при помощи ингибитора β-лактамаз авибактама, восстанавливающего чувствительность к цефтазидиму. Авибактам инактивирует β-лактамазы класса А (в том числе карбопенемазы Klebsiella pneumoneaeПри этом авибактам не эффективен против β-лактамаз класса B. По результатам исследования REPRISE, опубликованного в 2016 г. и включавшего пациентов с внутрибольничными инфекциями из 16 стран, 9 % больных оказались резистентными к терапии цефтазидимом/авибактамом.
Показания для применения цефтазидима/авибактама: осложненные интраабдоминальные инфекции, осложненные инфекции мочевыводящих путей, госпитальная пневмония (в том числе ИВЛ-ассоциированная), а также инфекции, вызванные полирезистентными грамотрицательными микроорганизмами при ограниченных возможностях терапии [1, 2].
Аналогичный подход к преодолению резистентности — комбинация известного антибиотика с очередным ингибитором β-лактамаз — реализован в препарате меропенем/ваборбактам (одобрен FDA в августе 2017 г. , в РФ не зарегистрирован).
, в РФ не зарегистрирован).
Цефтолозан/тазобактам, одобрен FDA в 2014 г., в РФ зарегистрирован с ноября 2018 г.
Цефтолозан — новый цефалоспорин V поколения. В отличие от предыдущего препарата, направлен в основном против P. aeruginosa. Благодаря более тяжелой боковой цепи цефтолозан малочувствителен к β-лактамазам класса С, а благодаря очень прочному связыванию с пенициллинсвязывающими белками не подвержен активному эффлюксу (выведению из бактериальной клетки) и не чувствителен к утере бактериями пориновых каналов, через которые проникает ряд других антибиотиков.
Тазобактам дополнительно инактивирует часть β-лактамаз класса А (но не карбапенемазы).
Показания к применению цефтолозана/тазобактама: осложненные интраабдоминальные инфекции, осложненные инфекции мочевыводящих путей [3].
Также ранее был зарегистрирован еще один цефалоспорин V поколения (FDA — 2010 г, РФ — 2012 г. ) — цефтаролина фосамил. Обладает широким спектром действия как против внебольничных грампозитивных (включая метициллинрезистентные штаммы
) — цефтаролина фосамил. Обладает широким спектром действия как против внебольничных грампозитивных (включая метициллинрезистентные штаммы
Далбаванцин, одобрен FDA в 2014 г., в РФ зарегистрирован в 2017 г.
Представитель класса полусинтетических липогликопептидов (гликопептидов с присоединенной липофильной боковой цепью), логическое «продолжение» ванкомицина, используемого с 1958 г. Как и предшественник, далбаванцин связывается с пептидогликанами в процессе синтеза клеточной стенки бактерий и нарушает его.
Препарат активен в отношении MRSA и метициллинрезистентного Staphylococcus epidermidis (MRSE), а также некоторых других стрептококков и энтерококков. Клинически значимой активности против грамнегативных бактерий не имеет. По данным исследований, показал сходную эффективность с комбинацией ванкомицин/линезолид в терапии инфекций кожи, но отличается удобством применения: две инъекции раз в неделю против двух инъекций в сутки в течение тех же двух недель.
Показания к применению далбаванцина: острые бактериальные инфекции кожи и мягких тканей [9].
Другой липогликопептид, оритаванцин (одобрен FDA в 2014 г., в РФ не зарегистрирован) обладает сходными с далбаванцином характеристиками, назначается по тем же показаниям, но вводится однократно.
Тедизолид, одобрен FDA в 2014 г., в РФ зарегистрирован в 2016 г.
Препарат класса оксазолидинонов II поколения. Оксазолидиноны — синтетические антибактериальные препараты, в основе которых лежит кольцевая молекула 2‑оксазолидона. Тедизолид — «потомок» хорошо зарекомендовавшего себя линезолида, впервые выпущенного в 2000 году.
Эффективен против широкого спектра грампозитивных бактерий, в том числе MRSA, различных стрептококков и энтерококков (в том числе ванкомицинрезистентных; VRE). Малоактивен в отношении грамнегативных бактерий.
Механизм действия: нарушает синтез бактериальных белков уже на этапе создания рибосомы, связываясь с ее 50S субъединицей.
Показания к применению тедизолида: острые бактериальные инфекции кожи и мягких тканей [10, 11].
Тиоуреидоиминометилпиридиния перхлорат, зарегистрирован в РФ в 2012 г.
Единственное в списке отечественное антибактериальное средство, допущено к применению также только в РФ. Это синтетический противотуберкулезный препарат, механизм действия которого окончательно не установлен. Также нет результатов контролируемого исследования с большим числом пациентов.
По предварительным данным, тиоуреидоиминометилпиридиния перхлорат увеличивает частоту прекращения бактериального выделения (основной критерий эффективности терапии) у пациентов с резистентным туберкулезом [12, 13].
Бедаквилин, одобрен FDA в 2012 г. , в РФ зарегистрирован в 2013 г.
, в РФ зарегистрирован в 2013 г.
Противотуберкулезный препарат, первое вещество, относящееся к новой группе антибактериальных препаратов — диарилхинолинам. Блокирует протонную помпу АТФ-синтазы микобактерий, нарушая выработку энергии для всех процессов в бактериальной клетке.
Эффективен в случаях туберкулеза со множественной лекарственной устойчивостью (к изониазиду и рифампицину) и широкой лекарственной устойчивостью микобактерий (к препаратам II линии и фторхинолонам), рекомендован ВОЗ в качестве препарата «последнего резерва». Не рекомендуется для повседневного использования [13, 14].
За эти годы был зарегистрирован и третий противотуберкулезный препарат, деламанид (Европейское агентство лекарственных средств — 2014 г., РФ — 2017 г.). Вещество ингибирует синтез метоксимиколевой кислоты и кетомиколевой кислоты, компонентов клеточной стенки микобактерий. Также показан к применению лишь в случаях активного туберкулеза со множественной лекарственной устойчивостью [13, 15].
Фидаксомицин, одобрен FDA в 2011 г., в РФ не зарегистрирован.
Первый представитель класса макроциклических антибиотиков, узкоспециализированный препарат. Выпускается в форме таблеток, всасывается минимально, а свои эффекты реализует в просвете кишечника, где обитает его единственная мишень — Clostridium difficile (возбудитель псевдомембранозного колита, — прим. ред.). Фидаксомицин нарушает транскрипцию бактериальной РНК. На несколько процентов более эффективен по сравнению с традиционно использующимися метронидазолом и ванкомицином, выгодно отличается от них меньшим количеством рецидивов, однако в сотни раз дороже обоих: стоимость курса составляет около $ 4000.
Показания для применения фидаксомицина: Cl. difficile-ассоциированная диарея, псевдомембранозный колит [4].
Делафлоксацин, одобрен FDA в 2017 г., в РФ не зарегистрирован.
Как и другие фторхинолоны, делафлоксацин нарушает репликацию ДНК и деление клеток, связывая ферменты ДНК-гиразу и топоизомеразу IV. Благодаря изменениям в структуре молекулы, от других препаратов группы отличается более высокой активностью в кислой среде, часто сопутствующей очагам инфекции, а также эффективностью против метициллинрезистентного S. aureus (MRSA). Активен и против ряда других грамположительных и — в меньшей степени — грамотрицательных бактерий.
Благодаря изменениям в структуре молекулы, от других препаратов группы отличается более высокой активностью в кислой среде, часто сопутствующей очагам инфекции, а также эффективностью против метициллинрезистентного S. aureus (MRSA). Активен и против ряда других грамположительных и — в меньшей степени — грамотрицательных бактерий.
Показания к применению делафлоксацина: острые бактериальные инфекции кожи и мягких тканей. Также препарат на данный момент проходит III фазу испытаний при внебольничной пневмонии [5].
Стоимость курса терапии — около $ 1500.
В 2014 г. FDA зарегистрировало фторхинолон для местного применения финафлоксацин. Он показан для лечения наружного отита при высевании P. aeruginosa или S. aureus. В декабре 2017 г. FDA также допустило к использованию нефторированный хинолон озеноксацин в форме крема для лечения импетиго — кожной инфекций, вызываемой S. aureus или Streptococcus pyogenes. Оба препарата в РФ не зарегистрированы.
Оба препарата в РФ не зарегистрированы.
Нефторированный хинолон немоноксацин, разработанный, выпускаемый и используемый на Тайване с 2014 г. для лечения острых бактериальных инфекций кожи и мягких тканей, а также внебольничной пневмонии, широкого международного признания пока не получил [6–8].
Плазомицин, одобрен FDA в июне 2018 г., в РФ не зарегистрирован.
Новый антибиотик-аминогликозид (так называемый «неогликозид»). Связывается с 30S субъединицей рибосомы, блокируя синтез бактериальных белков.
Активен в отношении многих аэробных грамнегативных бактерий, в том числе Enterobacteriaceae, продуцирующих β-лактамазы широкого спектра, карбапенемрезистентных энтеробактерий, а также микроорганизмов, продуцирующих аминогликозид-модифицирующие ферменты.
Показания к применению плазомицина: осложненные инфекции мочевыводящих путей, включая пиелонефрит.
Стоимость курса терапии, в зависимости от веса пациента и продолжительности лечения, — около $ 3300–4000 [16].
Рибосомы — мелкие клеточные органеллы, которые «собирают» белок из отдельных аминокислот. Состоят из двух субъединиц, большой и малой, которые различают по скорости осаждения при центрифугировании (чем больше размер, тем быстрее осаждение). Размеры большой и малой субъединиц у бактерий — 50S и 30S, у высших животных — 60S и 40S. Соответственно, препараты, блокирующие синтез белка бактерий, теоретически безопасны для рибосом человека.
Эравациклин, одобрен FDA в августе 2018 г., в РФ не зарегистрирован.
Синтетический тетрациклин, сходный по структуре с тигециклином, принятым к использованию еще в 2005 году. Эравациклин связывается с 30S субъединицей рибосом, блокируя присоединение аминокислоты и нарушая синтез белка. В отличие от предыдущих тетрациклинов, структурно защищен от активного эффлюкса и обходит бактериальную «защиту рибосом».
Антибиотик широкого спектра действия, к нему чувствительны грампозитивные S. aureus, включая MRSA, Streptococcus pneumoniae, энтерококки (в том числе ванкомицинрезистентные), а также грамнегативные бактерии: Acinetobacter baumannii, Haemophilus influenzae, Enterobacteriaceae, в ключая карбапенем-резистентные штаммы, и др.
aureus, включая MRSA, Streptococcus pneumoniae, энтерококки (в том числе ванкомицинрезистентные), а также грамнегативные бактерии: Acinetobacter baumannii, Haemophilus influenzae, Enterobacteriaceae, в ключая карбапенем-резистентные штаммы, и др.
Показания к применению эравациклина: осложненные интраабдоминальные инфекции [17].
Стоимость курса терапии сравнительно невысока — около $ 630–2000 за курс, в зависимости от веса пациента и продолжительности лечения.
Последний зарегистрированный на сегодняшний день антибиотик, омадациклин (одобрен FDA в октябре 2018 г., в РФ не зарегистрирован), также относится к тетрациклинам. Механизм действия и спектр активности сходен с эравациклином, но показания другие: внебольничная пневмония и острые бактериальные инфекции кожи и мягких тканей. Стоимость курса — более $ 3500 [18].
Источники
- Mosley JF 2nd, Smith LL, Parke CK, et al.
 Ceftazidime-Avibactam (Avycaz): For the Treatment of Complicated Intra-Abdominal and Urinary Tract Infections. P T. 2016; 41 (8):4 79–83. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4959616/
Ceftazidime-Avibactam (Avycaz): For the Treatment of Complicated Intra-Abdominal and Urinary Tract Infections. P T. 2016; 41 (8):4 79–83. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4959616/ - Carmeli Y, Armstrong J, Laud PJ, et al. Ceftazidime-avibactam or best available therapy in patients with ceftazidime-resistant Enterobacteriaceae and Pseudomonas aeruginosa complicated urinary tract infections or complicated intra-abdominal infections (REPRISE): a randomised, pathogen-directed, phase 3 study. Lancet Infect Dis. 2016; 16: 661-673. https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(16)30004-4/fulltext
- Hong MC, Hsu DI, Bounthavong M. Ceftolozane/tazobactam: a novel antipseudomonal cephalosporin and β-lactamase-inhibitor combination. Infect Drug Resist. 2013; 6: 215–23. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3848746/
- Zhanel GG, Walkty AJ, Karlowsky JA. Fidaxomicin: A novel agent for the treatment of Clostridium difficile infection.
 Can J Infect Dis Med Microbiol. 2015; 26 (6): 305–12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4692299/
Can J Infect Dis Med Microbiol. 2015; 26 (6): 305–12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4692299/ - Jorgensen SCJ, Mercuro NJ, Davis SL, Rybak MJ. Delafloxacin: Place in Therapy and Review of Microbiologic, Clinical and Pharmacologic Properties. Infect Dis Ther. 2018; 7 (2): 197–217. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5986682/
- Finafloxacin otic (Rx). Medscape. https://reference.medscape.com/drug/xtoro-finafloxacin-otic-999986
- Rosen T, Albareda N, Rosenberg N, et al. Efficacy and Safety of Ozenoxacin Cream for Treatment of Adult and Pediatric Patients With Impetigo: A Randomized Clinical Trial. JAMA Dermatol. 2018; 154 (7): 806–813. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6128489/
- Qin X, Huang H. Review of nemonoxacin with special focus on clinical development. Drug Des Devel Ther. 2014; 8: 765–74. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4094567/
- Smith JR, Roberts KD, Rybak MJ.
 Dalbavancin: A Novel Lipoglycopeptide Antibiotic with Extended Activity Against Gram-Positive Infections. Infect Dis Ther. 2015; 4 (3): 245–58. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4575294/
Dalbavancin: A Novel Lipoglycopeptide Antibiotic with Extended Activity Against Gram-Positive Infections. Infect Dis Ther. 2015; 4 (3): 245–58. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4575294/ - Rybak JM, Roberts K. Tedizolid Phosphate: a Next-Generation Oxazolidinone. Infect Dis Ther. 2015 r; 4 (1): 1–14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4363212/
- Дмитриева Н.В., Петухова И.Н., Григорьевская З.В., Багирова Н.С., Терещенко И.В. Сравнение клинической активности двух оксазолидинов – линезолида и тедизолида: неоправданные ожидания. Сибирский онкологический журнал. 2018; 17 (5): 87–93.
- Перхлозон®. Фармасинтез. https://pharmasyntez.com/products/protivotyberkyleznie-preparati/perkhlozon/?type=specialist
- Зеллвегер Ж.-П. Зеллвегер Ж.-П. Современные возможности лечения туберкулеза со множественной лекарственной устойчивостью микобактерий // BISSA. 2017. №4. С.5–12. https://cyberleninka.ru/article/n/sovremennye-vozmozhnosti-lecheniya-tuberkuleza-so-mnozhestvennoy-l.
 ..
.. - Pym AS, Diacon AH, Tang SJ, et al. Bedaquiline in the treatment of multidrug- and extensively drug-resistant tuberculosis. Eur Respir J. 2016; 47 (2): 564–74. https://erj.ersjournals.com/content/47/2/564.long
- Xavier AS, Lakshmanan M. Delamanid: A new armor in combating drug-resistant tuberculosis. J Pharmacol Pharmacother. 2014; 5 (3): 222–4. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4156838/
- Shaeer KM, Zmarlicka MT, Chahine EB, Piccicacco N, Cho JC. Plazomicin: A Next-Generation Aminoglycoside. Pharmacotherapy. 2019; 39 (1): 77–93. https://accpjournals.onlinelibrary.wiley.com/doi/full/10.1002/phar.2203
- FDA Approves New Antibacterial Eravacycline (Xerava). Medscape. https://www.medscape.com/viewarticle/901305
- Omadacycline (Rx). Medscape. https://reference.medscape.com/drug/nuzyra-omadacycline-1000262
Антибиотики при гайморите
Гайморит — серьезное заболевание, в основе развития которого лежит воспаление придаточных (гайморовых) пазух. В большинстве случаев причиной развития патологии являются патогенные микроорганизмы. К предрасполагающим факторам относится низкая защита иммунитета, анатомические особенности носовых ходов, околоносовых полостей, а также посттравматические изменения в данной зоне, которые нарушают вентиляцию в пазухах, сужают носовые проходы.
В большинстве случаев причиной развития патологии являются патогенные микроорганизмы. К предрасполагающим факторам относится низкая защита иммунитета, анатомические особенности носовых ходов, околоносовых полостей, а также посттравматические изменения в данной зоне, которые нарушают вентиляцию в пазухах, сужают носовые проходы.
Несвоевременное начало терапии может привести к развитию тяжелых осложнений, а именно инфицированию полости уха, оболочек головного мозга. Заподозрить гайморит можно на основании следующих симптомов:
- слизистые выделения из носа, которые постепенно приобретают гнойный характер и беспокоят более недели;
- заложенность носа из-за отека тканей, гиперсекреции, что заставляет человека дышать через рот;
- отсутствие обоняния;
- изменение вкуса;
- лихорадка выше 39 градусов;
- боль в околоносовой области, которая распространяется на лоб, глазницы, зубы и усиливается при наклонах, поворотах головы;
- недомогание;
- сонливость;
- снижение двигательной активности.

Чтобы вовремя диагностировать заболевание, необходимо пройти обследование у врача на этапе появления первых клинических признаков патологии. Проконсультироваться с квалифицированным отоларингологом можно в медицинском центре Здоровье столицы. Здесь работают опытные специалисты разного профиля, что позволяет оказать медицинскую помощь взрослым и детям.
Лечение гайморита основано на приеме антибактериальных средств. Они могут использоваться местно или системно. В зависимости от тяжести заболевания, состояния здоровья пациента, препараты могут назначаться для приема внутрь или инъекционно (внутримышечно, внутривенно).
Заметим, что дозу препаратов, вид антибиотика и длительность терапии устанавливает исключительно врач на основании результатов инструментального, лабораторного обследования. Самостоятельный прием лекарств может не только не принести облегчения общего состояния, но и ухудшить течение болезни, спровоцировать появление побочных реакций.
Далее рассмотрим группы антибактериальных средств, которые чаще всего используются в лечении гайморита.
- Пенициллиновый ряд. Препараты выпускаются в комбинации с клавулановой кислотой. К представителям данной группы антибиотиков относится Флемоксин, Амоксиклав, Аугментин, Флемоксин. Лекарства широко применяются в лечении гайморита у малышей. Для них продаются препараты в форме суспензии с добавлением фруктовых наполнителей для придания приятного вкуса.
- Цефалоспорины, такие как Цефтриаксон, Цефуроксим, Зефтера. Препараты делятся по поколениям, в зависимости от спектра действия в отношении патогенных микроорганизмов. Выбор лекарства осуществляется на основании результатов бакпосева биологического материала.
- Макролиды (Кларитромицин, Сумамед, Фромилид, Макропен) — действуют на внутриклеточные бактерии (хламидии, микоплазмы). Они назначаются в случае, когда вышеперечисленные антибиотики не могут быть использованы из-за аллергических реакций или их неэффективности.
Для местной терапии назначаются антибиотики из группы аминогликозидов. Они имеют большее количество побочных эффектов в сравнении с другими препаратами, поэтому крайне редко назначаются для системного введения.
Они имеют большее количество побочных эффектов в сравнении с другими препаратами, поэтому крайне редко назначаются для системного введения.
С целью интраназального введения применяются капли Полидекса. В своем составе они имеют не только антибиотик, но и сосудосуживающий, гормональный компонент. Спрей Изофра также назначается для местного использования. Помимо антибактериальных препаратов назначаются солевые растворы для промывания носовых ходов.
Комплексный подход терапии позволяет побороть инфекцию, уменьшить воспаление, устранить заложенность носа, восстановить носовое дыхание, облегчить общее состояние человека, а также предупредить развитие осложнений.
Последние Новости
Новый антибиотик широкого спектра не вызвал резистентности у бактерий
Механизмы действия вещества SCH-79797 и его производного IRS-16
James K. Martin II et al. / Cell, 2020
Martin II et al. / Cell, 2020
Ученые обнаружили новое антибактериальное вещество, активное против грамположительных и грамотрицательных бактерий и не вызывающее резистентность. Как говорится в статье, опубликованной в журнале Cell, вещество действует сразу на две цели: на метаболизм фолатов и на клеточную мембрану бактерий. Из-за двойного механизма действия бактерии не смогли выработать устойчивость к новому веществу.
За последние 20 лет для практического применения в медицине было одобрено всего шесть новых классов противомикробных препаратов, причем ни один из них не активен против грамотрицательных бактерий. Для сравнения, за первые 30 лет после открытия пенициллина в 1929 году было описано и внедрено в практику более двадцати классов антибиотиков. Такое резкое снижение темпов разработки и создания новых антимикробных препаратов часто связывают с экономическими факторами, ведь создание такого препарата стоит дорого и занимает много времени, а клинические испытания он может и вовсе не пройти.
Такое резкое снижение темпов разработки и создания новых антимикробных препаратов часто связывают с экономическими факторами, ведь создание такого препарата стоит дорого и занимает много времени, а клинические испытания он может и вовсе не пройти.
Поэтому фармакологические компании редко идут на риск, из-за чего в мире сложился кризис общественного здравоохранения: эволюция мультирезистентных бактерий, горизонтальный перенос генов резистентности между бактериями вкупе со старыми и уже не действующими препаратами — все это привело к появлению бактерий, на которые не действует практически ни один известный на сегодняшний день антибиотик. Самый яркий представитель этой когорты — метициллинрезистентный золотистый стафилококк, или MRSA. В нашем большом материале «Конец прекрасной эпохи» мы рассказывали про основные проблемы, с которыми сталкиваются врачи по всему миру, пытаясь лечить инфекции, вызванные устойчивыми к антибиотикам бактериями, и как вообще получилось, что потомки спасшего когда-то миллионы людей пенициллина не могут помочь нам сегодня.
Группа ученых под руководством Джеймса Мартина II (James K. Martin II) из Принстонского университета занималась поиском антибиотиков широкого спектра с новыми механизмами действия на бактериальные клетки. Исследование проводили на кишечной палочке, лишенной липополисахарида. Среди 33000 уникальных молекул ученые обратили внимание на одну — SCH-79797. Это антагонист рецептора, активируемого протеазой, первого типа, который обнаруживается на тромбоцитах, клетках иммунной системы, клетках эпителия и многих других клетках. Рецепторы этого класса участвуют в регуляции гемостаза и воспаления. Сам же SCH-79797 увеличивает способность нейтрофилов убивать бактерии, действуя, возможно, как антибиотик. Учитывая, что исследования, посвященные его антикоагулянтной активности, показали, что по крайней мере пять миллиграмм SCH-79797 на килограмм массы тела могут безопасно переноситься у животных, ученые решили исследовать, как же это вещество убивает бактерии.
Учитывая, что исследования, посвященные его антикоагулянтной активности, показали, что по крайней мере пять миллиграмм SCH-79797 на килограмм массы тела могут безопасно переноситься у животных, ученые решили исследовать, как же это вещество убивает бактерии.
При культуральном исследовании обнаружилось, что SCH-79797 подавляет рост грамотрицательных бактерий Neisseria gonorrhoeae и Acinetobacter baumannii, и грамположительных бактерий Enterococcus faecalis и Staphylococcus aureus. В том числе снижался рост колоний мультирезистентных штаммов N. gonorrhoeae и MRSA.
Исследование in vivo на личинках восковой моли, зараженной летальной дозой A. baumannii, показало низкую токсичность вещества: личинке вводили четырехкратную минимальную ингибирующую концентрацию SCH-79797, и она не вызвала значимых изменений жизнедеятельности. При этом выживаемость личинки значимо возросла (p < 0,001).
Выживаемость личинок G. mellonella, зараженных летальной дозой A. baumannii, при лечении различными антибиотиками. Выживаемость G. mellonella, получавшей SCH-79797, была аналогична выживаемости при применении контрольных антибиотиков: меропенема, рифампицина и гентамицина.
mellonella, зараженных летальной дозой A. baumannii, при лечении различными антибиотиками. Выживаемость G. mellonella, получавшей SCH-79797, была аналогична выживаемости при применении контрольных антибиотиков: меропенема, рифампицина и гентамицина.
James K. Martin II et al. / Cell, 2020
При высеивании метициллинрезистентного золотистого стафилококка на агар, содержащий четырехкратную минимальную ингибирующую концентрацию, ученым не удалось выделить стабильных мутантов, резистентных к SCH-79797. Для количественного определения показателей резистентности последовательно выращивали две биологически независимые культуры S. aureus MRSA на агаре с сублетальными концентрациями SCH-79797, а также с тремя контрольными антибиотиками: новобиоцином, триметопримом и низином. Через 25 дней бактерии не демонстрировали перекрестной устойчивости к SCH-79797. Чтобы распространить эти результаты на грамотрицательные виды, ученые повторили последовательное выращивание двух биологически независимых культур A. baumannii. Резистентность бактерии оставалась постоянной для SCH-79797, но повышалась для всех других антибиотиков, включая гентамицин. Таким образом, отсутствие резистентности не зависело от вида бактерии.
Чтобы распространить эти результаты на грамотрицательные виды, ученые повторили последовательное выращивание двух биологически независимых культур A. baumannii. Резистентность бактерии оставалась постоянной для SCH-79797, но повышалась для всех других антибиотиков, включая гентамицин. Таким образом, отсутствие резистентности не зависело от вида бактерии.Изменение резистентности A. baumannii к SCH-79797 и гентамицину
James K. Martin II et al. / Cell, 2020
С помощью программного анализа ученые доказали отличие механизма действия SCH-79797 от механизмов других известных антибиотиков. Чтобы найти искомую цель, с которой взаимодействует SCH-79797, ученые использовали анализ теплового сдвига: интактные клетки и клетки, обработанные препаратом, нагревают до определенных температур и собирают денатурированные растворимые белки при каждом значении температуры. Белки, которые связываются с препаратом, термически стабилизируются, что приводит к сдвигу температуры, при которой эти белки осаждаются. Оказалось, что SCH-79797 значительно изменил термическую стабильность дигидрофолатредуктазы (точнее ее гомолога у E. coli — FolA). В качестве положительного контроля использовали хорошо описанный ранее антибиотик триметоприм, нацеленный на дигидрофолатредуктазу (DHFR), и обнаружили, что он также термически стабилизирует свою известную цель — FolA.
Белки, которые связываются с препаратом, термически стабилизируются, что приводит к сдвигу температуры, при которой эти белки осаждаются. Оказалось, что SCH-79797 значительно изменил термическую стабильность дигидрофолатредуктазы (точнее ее гомолога у E. coli — FolA). В качестве положительного контроля использовали хорошо описанный ранее антибиотик триметоприм, нацеленный на дигидрофолатредуктазу (DHFR), и обнаружили, что он также термически стабилизирует свою известную цель — FolA.Схема анализа теплового сдвига, который сравнивает термическую стабильность всего протеома с лекарственной обработкой и без нее. Относительная доля растворимых и нерастворимых белков определяется с помощью ультрацентрифугирования и масс-спектрометрии
James K. Martin II et al. / Cell, 2020
Чтобы определить, как SCH-79797 влияет на метаболизм фолатов в живых клетках, ученые использовали масс-спектрометрию для измерения относительного количества пулов метаболитов фолата в E. coli NCM3722, обработанных SCH-79797. Клетки E. coli NCM3722 обрабатывали SCH-79797 в концентрации 13,9 миллиграмм на миллилитр (13 минимальных ингибирующих доз) в течение 15 мин. В ответ на это уровни субстрата DHFR — 7,8-дигидрофолата — выросли в 10 раз по сравнению с необработанными клетками, в то время как уровни метаболитов фолата значительно снизились. Такая картина характерна при ингибировании дигидрофолатредуктазы (FolA у E. coli). Аналогичная картина наблюдается при действии триметоприма — известного ингибитора DHFR.
coli NCM3722, обработанных SCH-79797. Клетки E. coli NCM3722 обрабатывали SCH-79797 в концентрации 13,9 миллиграмм на миллилитр (13 минимальных ингибирующих доз) в течение 15 мин. В ответ на это уровни субстрата DHFR — 7,8-дигидрофолата — выросли в 10 раз по сравнению с необработанными клетками, в то время как уровни метаболитов фолата значительно снизились. Такая картина характерна при ингибировании дигидрофолатредуктазы (FolA у E. coli). Аналогичная картина наблюдается при действии триметоприма — известного ингибитора DHFR.Из-за того, что SCH-79797 и триметоприм ингибируют дигидрофолатредуктазу, количество субстрата этого фермента — дигидрофолата (dihydrofolate) — увеличивается, а количество продукта реакции — тетрагидрофолата (tetrahydrofolate) — и последующих метаболитов фолата уменьшается
James K. Martin II et al. / Cell, 2020
/ Cell, 2020
Поскольку клетки, устойчивые к триметоприму, оказывались чувствительными к SCH-79797, ученые предположили, что у этого вещества есть еще одна мишень, при действии на которую бактериальные клетки погибали. Проточная цитометрия обработанных SCH-79797 клеток с флуоресцентными красителями выявила значительные изменения поляризации и проницаемости мембраны. Эти эффекты на мембрану не являются вторичными последствиями ингибирования дигидрофолатредуктазы, так как обработанная триметопримом кишечная палочка не показала существенных изменений поляризации и проницаемости мембраны. Таргетный эффект SCH-79797 на мембрану также не является видоспецифичным, так как аналогичные результаты были получены у B. subtilis. Эти результаты показывают, что независимо от своей способности ингибировать дигидрофолатредуктазу, SCH-79797 нарушает как мембранный потенциал, так и проницаемость клеточной мембраны.
Проточная цитометрия обработанных SCH-79797 клеток с флуоресцентными красителями выявила значительные изменения поляризации и проницаемости мембраны. Эти эффекты на мембрану не являются вторичными последствиями ингибирования дигидрофолатредуктазы, так как обработанная триметопримом кишечная палочка не показала существенных изменений поляризации и проницаемости мембраны. Таргетный эффект SCH-79797 на мембрану также не является видоспецифичным, так как аналогичные результаты были получены у B. subtilis. Эти результаты показывают, что независимо от своей способности ингибировать дигидрофолатредуктазу, SCH-79797 нарушает как мембранный потенциал, так и проницаемость клеточной мембраны.
Химический анализ SCH-79797 показал, что его ядро представлено пирролохиназолиндиамином, который ответственен за связывание с дигидрофолатредуктазой. Одной из двух боковых групп оказалась гидрофобная изопропилфенильная группа. Именно она изменяет проницаемость и поляризацию клеточной мембраны бактерии.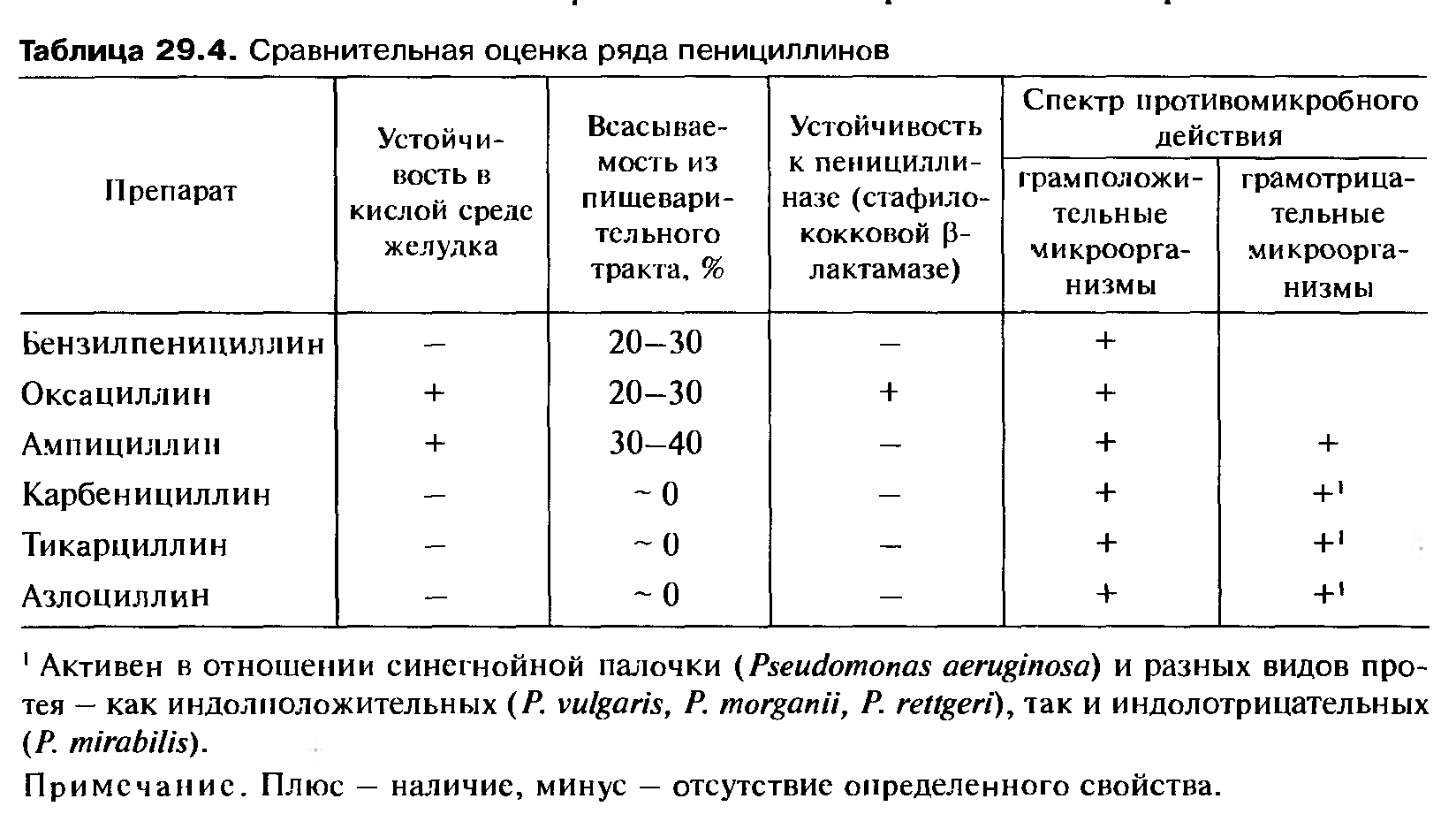 Ученые присоединили к SCH-79797 еще одну фенольную группу и получили более гидрофобное вещество IRS-16. В эксперименте IRS-16 показал высокую антибактериальную активность, связанную с нарушением метаболизма фолатов у бактерий и изменениями проницаемости и поляризации их клеточной стенки.
Ученые присоединили к SCH-79797 еще одну фенольную группу и получили более гидрофобное вещество IRS-16. В эксперименте IRS-16 показал высокую антибактериальную активность, связанную с нарушением метаболизма фолатов у бактерий и изменениями проницаемости и поляризации их клеточной стенки.
Химическое строение SCH-79797
James K. Martin II et al. / Cell, 2020
Химическое строение IRS-16
James K. Martin II et al. / Cell, 2020
SCH-79797 подавлял рост некоторых клеточных линий млекопитающих в связи с чем, ученые сосредоточили свое внимание на IRS-16, поскольку его летальная доза была в сто раз больше дозы, необходимой для убийства бактерий. Максимальная переносимая доза IRS-16 составила 15 миллиграмм на килограмм массы при внутривенном введении, при этой дозе концентрация IRS-16 в плазме достигала максимума — 1,4 миллиграмма на миллилитр с периодом полураспада 15,8 часов. Исследование микросомального аппарата печени исследуемых мышей показало высокую стабильность IRS-16.
Максимальная переносимая доза IRS-16 составила 15 миллиграмм на килограмм массы при внутривенном введении, при этой дозе концентрация IRS-16 в плазме достигала максимума — 1,4 миллиграмма на миллилитр с периодом полураспада 15,8 часов. Исследование микросомального аппарата печени исследуемых мышей показало высокую стабильность IRS-16.Наконец, ученые определили, обладает ли IRS-16 антибактериальной активностью в модели бактериальной инфекции у мыши. С этой целью они смоделировали вагинальную инфекцию N. gonorrhoeae, поскольку для этого грамотрицательного патогена существует острая потребность в новых антибиотиках из-за широко распространенной резистентности к существующим препаратам. В бактериальной культуре IRS-16 проявлял устойчивую активность в отношении N. gonorrhoeae с минимальной ингибирующей концентрацией 0,03 миллиграмма на миллилитр. IRS-16 должен сохраняться у мышей в концентрациях выше 0,03 миллиграмма на миллилитр в течение почти 48 ч. После заражения мышей N. gonorrhoeae им внутривенно ввели дозу из расчета 10 миллиграмм на килограмм. Через 26 часов IRS-16 достоверно снижал нагрузку N. gonorrhoeae (Р < 0,05). Высокий терапевтический индекс и фармакокинетический профиль подтверждает, что IRS-16 может действовать как эффективный антибиотик в модели гонореи мышей in vivo.
gonorrhoeae им внутривенно ввели дозу из расчета 10 миллиграмм на килограмм. Через 26 часов IRS-16 достоверно снижал нагрузку N. gonorrhoeae (Р < 0,05). Высокий терапевтический индекс и фармакокинетический профиль подтверждает, что IRS-16 может действовать как эффективный антибиотик в модели гонореи мышей in vivo.
Если вам интересно узнать что-то еще из мира новых антибиотиков, то обязательно обратите внимание на книгу Мэтта Маккарти, в которой он рассказывает про новый антибиотик, применяемый при инфекциях кожи и мягких тканей, приводит клинические случаи и рассуждает на тему будущего антибиотикотерапии.
Вячеслав Гоменюк
Лечащихся от COVID-19 на дому обеспечат лекарствами и масками – Газета.uz
Граждане, у которых подтверждена коронавирусная инфекция COVID-19 и которые по рекомендации врачей лечатся дома, будут бесплатно обеспечены лекарственными средствами и одноразовыми лицевыми масками. Такое решение принято 16 июля на заседании Специальной республиканской комиссии по борьбе с коронавирусом, которое прошло под руководством премьер-министра Узбекистана Абдуллы Арипова.
Такое решение принято 16 июля на заседании Специальной республиканской комиссии по борьбе с коронавирусом, которое прошло под руководством премьер-министра Узбекистана Абдуллы Арипова.
Как говорится в сообщении комиссии, в список лекарств, которыми должны обеспечиваться пациенты на домашнем лечении, вошли «Гидроксихлорохин», «Азитромицин», «Парацетамол» и витамин С.
Министерству здравоохранения и соответствующим ведомствам поручено в срочном порядке сформировать резерв из 50 тысяч комплектов указанных препаратов и наладить систему их доставки по адресам.
В интервью «Газете.uz» член штаба по коронавирусу, профессор Хабибулла Акилов отмечал, что медикаментозного лечения на дому не требуется. По его словам, лечение препаратами должно проводиться под наблюдением врачей.
«Лечение, которое проводится даже пациентам с легкими симптомами в стационаре, плаквенилом (торговая марка гидроксихлорохина — ред.), оно должно выполняться сугубо под контролем электрокардиограммы (ЭКГ), потому что наблюдаются нарушения ритма сердца.
Без наличия каких-то симптомов и осложнений рекомендовать азитромицин (полусинтетический антибиотик широкого спектра действия — ред.) тоже не следует, потому что будет привыкание, а потом, когда действительно понадобится делать азитромицин, он уже не будет работать. Поэтому в домашних условиях нужно лечение, которое повышает иммунитет, и, возможно, какое-то легкое противовирусное профилактическое лечение…», — заявлял он.
15 июля на совещании президент Узбекистана Шавкат Мирзиёев подверг критике Министерство здравоохранения и хокимияты за ненадлежащую работу по предотвращению распространения коронавируса и лечению больных.
По поручению президента начата работа по усилению службы скорой помощи, центров обработки вызовов, улучшению системы сдачи тестов на COVID-19 и решению проблемы доступности лекарств в аптеках.
ОТЕЧЕСТВЕННЫЙ ПРОТИВОВИРУСНЫЙ ПРЕПАРАТ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ — УМИФЕНОВИР КАК СРЕДСТВО ЭТИОТРОПНОЙ ТЕРАПИИ ГРИППА | Осидак
1. Карпова Л.С., Пелих М.Ю., Столяров К.А., Поповцева Н.М., Столярова Т.П. Пандемия гриппа в России как часть глобального распространения гриппа А (Н1N1)pdm09 в 2009—2011 гг. // Вопросы вирусологии. 2012; 6: 26—30. Karpova L.S., Pelih M.Ju., Stoljarov K.A., Popovceva N.M., Stoljarova T.P. [An Influenza Pandemic in Russia as a Part of a Global Spread of the Influenza A (h2N1)pdm 09 in 2009-2011] // Voprosy Virusologii. 2012; 6:26—30. (In Russ.)
Карпова Л.С., Пелих М.Ю., Столяров К.А., Поповцева Н.М., Столярова Т.П. Пандемия гриппа в России как часть глобального распространения гриппа А (Н1N1)pdm09 в 2009—2011 гг. // Вопросы вирусологии. 2012; 6: 26—30. Karpova L.S., Pelih M.Ju., Stoljarov K.A., Popovceva N.M., Stoljarova T.P. [An Influenza Pandemic in Russia as a Part of a Global Spread of the Influenza A (h2N1)pdm 09 in 2009-2011] // Voprosy Virusologii. 2012; 6:26—30. (In Russ.)
2. Цыбалова Л.М., Карпова Л.С., Комиссаров А.Б., Еропкин М.Ю., Грудинин М.П. Киселев О.И. Эпидемия гриппа A(h2N1)v 2009 г. в России // Вестник РАМН. 2011. №6. С.30—36. Tsybalova L.M., Karpova L.S., Komissarov A.B., Eropkin M.Ju., Grudinin M. P., Kiselev O. I. [Influenza A (h2N1)V2009 Epidemic in Russia] // Vestnik RAMN. 2011; 6:30—36. (In Russ.)
3. Азаренок А.А., Прочуханова А.Р., Зенин В.В., Люблинская О. Г., Козлова Н.М., Жилинская И.Н. Способность вирусов гриппа и их поверхностных белков стимулировать апоптоз и некроз клеток эндотелия in vitro // Цитология. 2013. T. 55, №6. С. 430—435. Azarenok A.A., Prochukhanova A.R., Zenin A.R., Lyublynskaja O.G., Koslova N.M., Zhilinskaja I.N. et al. [The ability of influenza viruses and their surface proteins to stimulate apoptosis and necrosis of endothelial cells in vitro he ability of influenza viruses and their surface proteins stimulate] // Citologia. 2013. T. 55, №6. P. 430—435. (In Russ.)
Г., Козлова Н.М., Жилинская И.Н. Способность вирусов гриппа и их поверхностных белков стимулировать апоптоз и некроз клеток эндотелия in vitro // Цитология. 2013. T. 55, №6. С. 430—435. Azarenok A.A., Prochukhanova A.R., Zenin A.R., Lyublynskaja O.G., Koslova N.M., Zhilinskaja I.N. et al. [The ability of influenza viruses and their surface proteins to stimulate apoptosis and necrosis of endothelial cells in vitro he ability of influenza viruses and their surface proteins stimulate] // Citologia. 2013. T. 55, №6. P. 430—435. (In Russ.)
4. Takizawa T., Nacanishi Y. Role and pathological Significance of Apoptosis Induced by influenza // The Open Antimicrobial Agent Journal. 2010. Vol. 2. Р. 22—25.
5. Жилинская И.Н., Азаренок А.А., Ильинская Е.В., Прочуханова А.Р., Воробьев С.Л., Сорокин Е.В. и др. Репродукция вируса гриппа в клетках эндотелия кровеносных сосудов человека // Вопросы вирусологии. 2012, № 2. С. 20—23.иZhilinskaja I.N., Azarenok A.A., Ilynskaja E.V., Prochukhanova A.R., Vorobjev S.L., Sorokin E.V. et al. [Influenza virus reproduction in the endothelium cells of human blood vessels] // Voprosy Virusologii. 2012; 2:20—23. (In Russ.)
2012, № 2. С. 20—23.иZhilinskaja I.N., Azarenok A.A., Ilynskaja E.V., Prochukhanova A.R., Vorobjev S.L., Sorokin E.V. et al. [Influenza virus reproduction in the endothelium cells of human blood vessels] // Voprosy Virusologii. 2012; 2:20—23. (In Russ.)
6. Armstrong S.M., Wang C., Tigdi J., Si X., Dumpit C., Charles S., [et al.]. Influenza infects lungs microvascular endothelium leading to microvascular leak: role of apoptosis and claudin-5 // PLoS One. 2012. Vol. 7:e47323.
7. Симбирцев А.С. Цитокины новая система регуляции защитных реакций организма // Цитокины и воспаление. 2002. Том 1, № 1. С. 9—16. Simbirtsev А.S. [Cytokines new system of regulation of protective reactions of the organism] // Cytokines and Inflammation. 2002. Том 1,№ 1. P. 9—16. (In Russ.)
8. Александрова Н. Н., Гусев Е. В., Мальчиков И. А. Синдром системного воспалительного ответа при тяжелых формах гриппозной инфекции // Человек и лекарство: Сб. материалов XV национального конгресса. — М., 2008. — С. 19. Aleksandrova N.N., Gusev E.V., Malchikov I.A. [Systemic inflammatory response syndrome and sеverе degry of Influenza infections] // А мan and medicine: The collection of materials of the XV national Congress. — М., 2008. — P. 19. (In Russ.)
Александрова Н. Н., Гусев Е. В., Мальчиков И. А. Синдром системного воспалительного ответа при тяжелых формах гриппозной инфекции // Человек и лекарство: Сб. материалов XV национального конгресса. — М., 2008. — С. 19. Aleksandrova N.N., Gusev E.V., Malchikov I.A. [Systemic inflammatory response syndrome and sеverе degry of Influenza infections] // А мan and medicine: The collection of materials of the XV national Congress. — М., 2008. — P. 19. (In Russ.)
9. Романова Е.А. Пневмонии у больных гриппом А/h2N1/09: клинико-патогенетические закономерности и исходы: Автореф. дисс. … доктор медицинских наук — Чита, 2014. Romanova E.A. [Pneumonia in patients with influenza A/h2N1/09: the clinical and pathogenetic patterns and outcomes]: Author. Dis. … MD. — Chita, 2014. (In Russ.)
10. Осидак Л.В., Гончар В.В., Волощук Л.В., Головачева Е.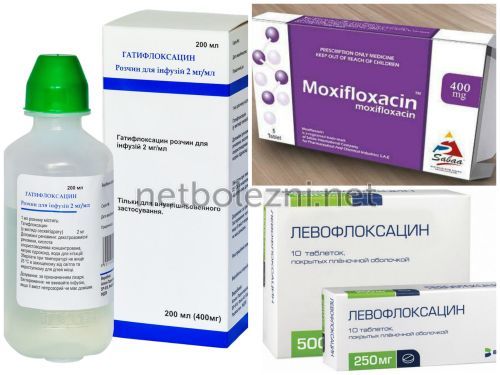 Г., Куликова Н.А., Дондурей Е.А. и др.Клинико-лабораторная характеристика гриппа А(Н1N1pdm2009) у детей и взрослых в период 2009—2013 гг. в Санкт-Петербурге // Вопросы вирусологии. 2015; 60(4). С.23—28. Osidak L.V., Gonchar V.V., Voloshuk L.V., Golovacheva E.G., Сulikova N.A., Dondurey E.A. еt al. [Clinical and laboratory presentation Influenza A (h2N1)V2009 in children and adults during the period of 2009—2013 in Sait-Petersburg] // Voprosy Virusologii. 2015; 60(4). P.23—28. (In Russ.)
Г., Куликова Н.А., Дондурей Е.А. и др.Клинико-лабораторная характеристика гриппа А(Н1N1pdm2009) у детей и взрослых в период 2009—2013 гг. в Санкт-Петербурге // Вопросы вирусологии. 2015; 60(4). С.23—28. Osidak L.V., Gonchar V.V., Voloshuk L.V., Golovacheva E.G., Сulikova N.A., Dondurey E.A. еt al. [Clinical and laboratory presentation Influenza A (h2N1)V2009 in children and adults during the period of 2009—2013 in Sait-Petersburg] // Voprosy Virusologii. 2015; 60(4). P.23—28. (In Russ.)
11. Арбидол: эффективность в терапии гриппа и других ОРВИ: Методическое пособие под редакцией д.б.н. И.А. Ленева. — М., 2014. — 84 с. [Arbidol: efficiency in the treatment of influenza and other ARVI]: A methodological guide ed. Leneva I.A. — М., 2014. — 84 p. (In Russ.)
12. Blaising J. Stephen J. Polyakb, Eve-Isabelle Pécheur. Arbidol as a broad-spectrum antiviral: An update // Antiviral Res. (2014) http://dx.doi.org/10.1016/j.antiviral.2014.04.006
(2014) http://dx.doi.org/10.1016/j.antiviral.2014.04.006
13. Лабораторная диагностика синдрома эндогенной интоксикации: Метод. рекомендации / Под ред. И.П. Корюкиной. — Пермь: ПГМА, 2005. — 39 с. [Laboratory diagnosis of endogenous intoxication: Method. recommendations] / ed. I.P. Koryukinа. — Perm: PGMA, 2005. — 39 p. (In Russ.)
14. Осидак Л.В., Головачева Е.Г., Дондурей Е.А., Афанасьева О.И., Образцова Е.В., Дриневский В.П. и др. Противовирусная терапия и профилактика острых респираторных инфекций // Детские инфекции. 2012. Т11, Спецвыпуск. С.16—23. Osidak L.V., Golovacheva E.G., Dondurey E.A., Afanasyeva O.I., Obraztsova E.V., Drinevsky V.P. et al. [Antiviral therapy and prevention of acute respiratory infections] // Children Infections. 2012. Т11, Special edition. P.16—23. (In Russ.)
15. Петров В.И., Недогода С.В., Ленева И.А. Применение отечественного противовирусного препарата с позиций доказательной медицины // Лечащий врач. Январь 2011. №1, С. 71—79. Petrov V.I., Nedogoda S.V., Leneva I.A. [The use of domestic antiviral drug from the standpoint of evidence-based medicine] // Lechaschiy Vrach. 2011. №1, P. 71—79. (In Russ.)
Петров В.И., Недогода С.В., Ленева И.А. Применение отечественного противовирусного препарата с позиций доказательной медицины // Лечащий врач. Январь 2011. №1, С. 71—79. Petrov V.I., Nedogoda S.V., Leneva I.A. [The use of domestic antiviral drug from the standpoint of evidence-based medicine] // Lechaschiy Vrach. 2011. №1, P. 71—79. (In Russ.)
Использование антибактериальных препаратов у недоношенных новорождённых: опыт создания формуляра | Ивжиц
Антибиотики уникальные препараты, которые произвели революцию в борьбе с инфекциями. Однако с момента начала их использования возникли и до сих пор не решены проблемы всё более и более растущей резистентности микроорганизмов. Это стало одной из основных глобальных проблем общественного здравоохранения. Врачи всех специальностей порой чрезмерно и неправильно используют антибактериальные средства, что ставит под угрозу эффективность противомикробных препаратов для будущих поколений.
Основными проблемными микроорганизмами в условиях реанимаций и детских отделений являются Гр(+) кокки и Гр(-) Enterobacteriaceae, грибы рода Candida albicans и non-albicans, отличающиеся особой резистентностью.
В последние 5-8 лет отмечается драматический рост стафилококковых и стрептококковых инфекций, вызванных полирезистентными штаммами, устойчивыми ко всем b-лактамным антибиотикам (пенициллинам, цефалоспоринам, монобактамам и карбапенемам), а также к макролидам, аминогликозидам, тетрациклинам и другим антибактериальным препаратам. Такой полирезистентностью характеризуются так называемые метициллинрезистентные (или окса- циллинрезистентные) стафилококки (MRSA) S.aureus, в том числе коагулазонегативные (CNS) S.epidermidis, пенициллин-резистентные стрептококки Streptococcus pneumoniae, S.viridans, полирезистентные энтерококки Enterococcus faecalis и E.faecium. В клинической практике это означает, что целый ряд известных заболеваний, вызванных такими возбудителями, не поддаются традиционным схемам лечения. Препаратами выбора для лечения такого рода инфекций выступают гликопептиды, высокоактивные в отношении названных проблемных микроорганизмов. Гликопептиды — ванкомицин и тейкопланин (не зарегистрирован в России), антибиотики узкого спектра действия, являются общепризнанными препаратами выбора для лечения инфекций, вызванных проблемными полирезистентными грамположительными кокками: стафилококками, стрептококками и энтерококками. Механизм действия гликопептидов отличен от других антибиотиков и представляет собой блокирование синтеза пептидогликана клеточной стенки грамположительных бактерий путём необратимого связывания с концевым участком аминокислотного мостика, участвующего в образовании поперечных сшивок между полисахаридными цепями D-Ala -D-Ala [1]. Гликопептиды неактивны в отношении практически всех грамотрицательных микроорганизмов, так как крупная молекула гликопептидных антибиотиков не способна проникать через их внешнюю мембрану, поэтому ванкомицин часто используют в комбинациях с препаратами активными в отношении ГР(-) возбудителей, например, с антисинегнойными цефалоспоринами 3-4 поколения, карбапенемами.
Препаратами выбора для лечения такого рода инфекций выступают гликопептиды, высокоактивные в отношении названных проблемных микроорганизмов. Гликопептиды — ванкомицин и тейкопланин (не зарегистрирован в России), антибиотики узкого спектра действия, являются общепризнанными препаратами выбора для лечения инфекций, вызванных проблемными полирезистентными грамположительными кокками: стафилококками, стрептококками и энтерококками. Механизм действия гликопептидов отличен от других антибиотиков и представляет собой блокирование синтеза пептидогликана клеточной стенки грамположительных бактерий путём необратимого связывания с концевым участком аминокислотного мостика, участвующего в образовании поперечных сшивок между полисахаридными цепями D-Ala -D-Ala [1]. Гликопептиды неактивны в отношении практически всех грамотрицательных микроорганизмов, так как крупная молекула гликопептидных антибиотиков не способна проникать через их внешнюю мембрану, поэтому ванкомицин часто используют в комбинациях с препаратами активными в отношении ГР(-) возбудителей, например, с антисинегнойными цефалоспоринами 3-4 поколения, карбапенемами. Совместное применение с аминогликозидами потенцирует нефротоксические эффекты обоих препаратов, следует избегать такого рода комбинации. Второй препарат, активный в отношении MRSA и ванкомицин-резистентных (VRSA) инфекций, антибиотик класса оксазолидинонов — линезолид. Считают, что линезолид обладает бактериостатическим действием против большинства микроорганизмов (то есть, он останавливает их рост и размножение, фактически не убивая их), но также обладает бактерицидным действием в отношении стрептококков [2, 3]. Некоторые авторы отмечают, что, несмотря на его бактериостатическое действие in vitro, линезолид «ведёт себя» как бактерицидный антибиотик in vivo, поскольку он ингибирует образование токсинов стафилококков и стрептококков [4]. Он также обладает пост-антибиотическим действием на большинство бактерий от одного до четырёх часов, что означает временное подавление роста бактерий даже после прекращения приёма препарата [5].
Совместное применение с аминогликозидами потенцирует нефротоксические эффекты обоих препаратов, следует избегать такого рода комбинации. Второй препарат, активный в отношении MRSA и ванкомицин-резистентных (VRSA) инфекций, антибиотик класса оксазолидинонов — линезолид. Считают, что линезолид обладает бактериостатическим действием против большинства микроорганизмов (то есть, он останавливает их рост и размножение, фактически не убивая их), но также обладает бактерицидным действием в отношении стрептококков [2, 3]. Некоторые авторы отмечают, что, несмотря на его бактериостатическое действие in vitro, линезолид «ведёт себя» как бактерицидный антибиотик in vivo, поскольку он ингибирует образование токсинов стафилококков и стрептококков [4]. Он также обладает пост-антибиотическим действием на большинство бактерий от одного до четырёх часов, что означает временное подавление роста бактерий даже после прекращения приёма препарата [5].
Ведущим ГР(-) микроорганизмами, отличающимися полирезистентностью, является P. aeruginosa. Общими подходами при лечении данной инфекции являются следующие правила: комбинированная антибактериальная терапия, воздействующая на разные мишени (клеточная стенка, рибосомы), а, следовательно, это могут быть комбинации антисинегнойных цефалоспоринов 3 поколения + ами- ногликозиды, карбапенемы + аминогликозиды. К аминогликозидам синегнойная палочка сохраняет высокий уровень чувствительности, а комбинации АБ помогают преодолеть механизмы резистентности, так как P. aeruginosa сложнее одновременно приспосабливаться к действию сразу 2 антибактериальных препаратов и мутировать в разных направлениях. В настоящее время восстанавливается чувствительность к пиперациллину/тазобактаму — препарату из группы защищенных пенициллинов. Высокую антисинегнойную активность показывают полимиксины группы В (вилимиксин) и М. Это одни из ранних классов природных антимикробных препаратов, открытый в 1947 г. Полимиксины (полимиксин В, полимиксин М, колистин (полимиксин Е)) являются циклическими полипептидами, синтезируемыми спорообразующей палочкой Bacillus polymixa.
aeruginosa. Общими подходами при лечении данной инфекции являются следующие правила: комбинированная антибактериальная терапия, воздействующая на разные мишени (клеточная стенка, рибосомы), а, следовательно, это могут быть комбинации антисинегнойных цефалоспоринов 3 поколения + ами- ногликозиды, карбапенемы + аминогликозиды. К аминогликозидам синегнойная палочка сохраняет высокий уровень чувствительности, а комбинации АБ помогают преодолеть механизмы резистентности, так как P. aeruginosa сложнее одновременно приспосабливаться к действию сразу 2 антибактериальных препаратов и мутировать в разных направлениях. В настоящее время восстанавливается чувствительность к пиперациллину/тазобактаму — препарату из группы защищенных пенициллинов. Высокую антисинегнойную активность показывают полимиксины группы В (вилимиксин) и М. Это одни из ранних классов природных антимикробных препаратов, открытый в 1947 г. Полимиксины (полимиксин В, полимиксин М, колистин (полимиксин Е)) являются циклическими полипептидами, синтезируемыми спорообразующей палочкой Bacillus polymixa. Полимиксины обладают уникальным механизмом бактерицидного действия, основанном на нарушении структуры наружной клеточной мембраны грамотрицательных бактерий за счёт вытеснения катионов кальция и магния из образующих их липосахаридов (ЛПС), что приводит к дестабилизации и повышению проницаемости мембраны и последующей гибели микробной клетки [6]. Благодаря такому механизму полимиксины, помимо антибактериального действия, обладают способностью нейтрализовать активность эндотоксина грамотрицательных бактерий, представляющего собой липидную часть молекулы ЛПС. Характеризуются узким спектром активности и высокой токсичностью. Полимиксины достаточно редко (в основном — при муковисцидозе) применялись с начала 80-х гг. ХХ века из-за выраженной нефро- и нейротоксичности и появления более безопасных антисинегнойных антимикробных препаратов. Однако в последнее время рост частоты инфекций, вызванных полирезистентными штаммами грамотрицательных бактерий (в первую очередь, P. aeruginosa, Acinetobacter spp.
Полимиксины обладают уникальным механизмом бактерицидного действия, основанном на нарушении структуры наружной клеточной мембраны грамотрицательных бактерий за счёт вытеснения катионов кальция и магния из образующих их липосахаридов (ЛПС), что приводит к дестабилизации и повышению проницаемости мембраны и последующей гибели микробной клетки [6]. Благодаря такому механизму полимиксины, помимо антибактериального действия, обладают способностью нейтрализовать активность эндотоксина грамотрицательных бактерий, представляющего собой липидную часть молекулы ЛПС. Характеризуются узким спектром активности и высокой токсичностью. Полимиксины достаточно редко (в основном — при муковисцидозе) применялись с начала 80-х гг. ХХ века из-за выраженной нефро- и нейротоксичности и появления более безопасных антисинегнойных антимикробных препаратов. Однако в последнее время рост частоты инфекций, вызванных полирезистентными штаммами грамотрицательных бактерий (в первую очередь, P. aeruginosa, Acinetobacter spp. ) потребовал пересмотра отношения к полимиксинам и возвращения данной группы антибиотиков в широкую клиническую практику в основном как препаратов глубокого резерва для лечения панрезистентных Enterobacteriaceae и ГОНФБ. С учётом профиля безопасности следует избегать совместного применения полимиксинов с другими нефротоксичными препаратами (петлевыми диуретиками, аминогликозидами), так как потенцируется нефротоксический эффект.
) потребовал пересмотра отношения к полимиксинам и возвращения данной группы антибиотиков в широкую клиническую практику в основном как препаратов глубокого резерва для лечения панрезистентных Enterobacteriaceae и ГОНФБ. С учётом профиля безопасности следует избегать совместного применения полимиксинов с другими нефротоксичными препаратами (петлевыми диуретиками, аминогликозидами), так как потенцируется нефротоксический эффект.
Крайне проблемным возбудителем тяжёлых инфекций является Acinetobacter spp., который обладает природной резистентностью ко многим антибиотикам. Природными резервуарами данного микроорганизма являются почва, богатая грибами, вырабатывающими природные антибиотики, поэтому эволюционно Acinetobacter приспособился инактивировать различные антибиотики, однако при этом сохраняет природную чувствительность к сульбактаму. Поэтому препаратами выбора могут выступать цефоперазон/сульбактам, из расчёта по сульбактаму, карбапенемы, фторхинолоны. Acinetobacter baumannii способен колонизировать обычно стерильные объекты, выживать как в сухих, так и во влажных условиях госпитальной среды. Переносчиками инфекции могут выступать руки медперсонала, панели мобильных телефонов, фонендоскопы. Колонизации обычно подвергаются предметы, окружающие пациента (матрацы, постельное белье, кровати, прикроватные столики и тумбочки, кислородные и водопроводные краны, вода, использующаяся в аппаратах ИВЛ или для назогастрального введения), а также использующиеся для ухода за ним, контроля его состояния, осуществления лечебных манипуляций. Как правило, суперинфекция с участием Acinetobacter baumannii развивается после или на фоне терапии карбапенемами (то есть Acinetobacter baumannii занимает все освободившиеся локусы в организме на фоне мощного селективного давления карбапенемов). Изначально этот микроб считался сапрофитом с низкими вирулентными свойствами, но в настоящее время это один из самых устойчивых к антимикробной терапии госпитальных микроорганизмов [7].
Переносчиками инфекции могут выступать руки медперсонала, панели мобильных телефонов, фонендоскопы. Колонизации обычно подвергаются предметы, окружающие пациента (матрацы, постельное белье, кровати, прикроватные столики и тумбочки, кислородные и водопроводные краны, вода, использующаяся в аппаратах ИВЛ или для назогастрального введения), а также использующиеся для ухода за ним, контроля его состояния, осуществления лечебных манипуляций. Как правило, суперинфекция с участием Acinetobacter baumannii развивается после или на фоне терапии карбапенемами (то есть Acinetobacter baumannii занимает все освободившиеся локусы в организме на фоне мощного селективного давления карбапенемов). Изначально этот микроб считался сапрофитом с низкими вирулентными свойствами, но в настоящее время это один из самых устойчивых к антимикробной терапии госпитальных микроорганизмов [7].
Klebsiella pneumoniae — вид грамотрицательных факультативно-анаэробных условно-патогенных бактерий. Входит в состав нормальной микрофлоры кишечника, кожи, ротовой полости человека. Klebsiella pneumoniae колонизирует кишечник человека в первые 5-6 дней жизни, причём основным источником Klebsiella pneumoniae являются мать и персонал родильных домов. Обнаружение Klebsiella pneumoniae в желудочно-кишечном тракте (ЖКТ) человека, в общем случае, не требует лечения. У здорового человека в 1 г кала насчитывается до 105 Klebsiella pneumoniae.
Klebsiella pneumoniae колонизирует кишечник человека в первые 5-6 дней жизни, причём основным источником Klebsiella pneumoniae являются мать и персонал родильных домов. Обнаружение Klebsiella pneumoniae в желудочно-кишечном тракте (ЖКТ) человека, в общем случае, не требует лечения. У здорового человека в 1 г кала насчитывается до 105 Klebsiella pneumoniae.
В то же время, при нарушении функционирования органов ЖКТ или в результате внешних воздействий, возможно значительное увеличение количества Klebsiella pneumoniae в организме и развитие инфекции. В частности, при назначении антибиотиков не всегда учитывается их влияние на микробную флору, заселяющую кишечник. Антибактериальные препараты подавляют рост не только патогенных микроорганизмов, но и нормальную микрофлору. В результате размножаются сапрофитные микробы (клебсиелла, стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка и др.) приобретающие патогенные свойства. Препаратами выбора для лечения инфекции, вызванной Klebsiella pneumoniae, являются защищенные цефалоспорины 3 поколения, цефалоспорины 4 поколения, карбапенемы. В случае панрезистентных Klebsiella pneumoniae возможно сочетать карбапенемы с аминогликозидами, с защищенными цефалоспоринами 3 поколения (с целью защиты карбапенема от бета-лактамаз за счёт сульбактама). В качестве антибиотиков глубокого резерва возможно использование полимиксинов.
В случае панрезистентных Klebsiella pneumoniae возможно сочетать карбапенемы с аминогликозидами, с защищенными цефалоспоринами 3 поколения (с целью защиты карбапенема от бета-лактамаз за счёт сульбактама). В качестве антибиотиков глубокого резерва возможно использование полимиксинов.
Candida spp. Грибковые инфекции занимают 3 место среди госпитальных инфекций в ОРИТ новорождённых и недоношенных детей. Частота инвазивного кандидоза от 2,6 до 18% у детей с очень низкой массой тела (ОНМТ) и экстремально низкой массой тела (ЭНМТ). Инвазивный кандидоз — грибковая инфекция, которая возникает при проникновении (инвазии) грибов Candida spp. в кожу, слизистые оболочки, в кровь (кандидемия), а также в случаях диссеминации возбудителя в ткани головного мозга и других внутренних органов. Инвазивный кандидоз обусловлен внедрением нитчатой формы гриба Candida spp. в ткани. Инвазивный кандидоз чаще наблюдается в органах, выстланных многослойным плоским эпителием (полость рта, пищевод), и реже цилиндрическим эпителием (желудок, кишечник), что, вероятно, связано с особенностями местной иммунной защиты. Наиболее часто используемые препараты для лечения кандидоза — это флуконазол и вориканозол (производные триазола). В настоящий момент к флуконазолу появился высокий уровень резистентности Candida spp, в связи с чем на первый план выходит применение противогрибковых препаратов других групп, таких как эхинокандины, отличающихся более широким спектром действия и преодолевающих имеющуюся резистентность.
Наиболее часто используемые препараты для лечения кандидоза — это флуконазол и вориканозол (производные триазола). В настоящий момент к флуконазолу появился высокий уровень резистентности Candida spp, в связи с чем на первый план выходит применение противогрибковых препаратов других групп, таких как эхинокандины, отличающихся более широким спектром действия и преодолевающих имеющуюся резистентность.
Особенно сложной проблемой является назначение антибиотиков у новорождённых и недоношенных детей. Это связано с физиологическими процессами, влияющими на фармакокинетику лекарств (всасывание, выведение и другие) у детей, в связи с чем в большинстве случаев требуется изменение дозировки препарата и кратности введения.
В период новорождённости влияние лекарств на организм ребёнка особенно велико. Это связано с недостаточностью ферментов, незрелостью многих систем, в том числе центральной нервной системы. Весь путь лекарства в организме человека любого возраста можно разделить на четыре этапа: всасывание, распределение, биотрансформация и экскреция. И каждый из этих этапов в детском организме имеет свои особенности, которые врач должен учитывать при назначении лекарств.
И каждый из этих этапов в детском организме имеет свои особенности, которые врач должен учитывать при назначении лекарств.
Всасывание лекарств у детей происходит по тем же законам, что и у взрослых, однако имеет некоторые особенности. Например, из-за малой мышечной массы и недостаточности периферического кровообращения трудно предсказать, какие результаты могут дать внутримышечное и подкожное введение лекарств. Препарат может оставаться в мышце и всасываться медленнее, чем ожидалось. Но в какой-то момент возможна активация кровообращения (использование грелки, физические упражнения), и тогда в общий кровоток быстро и неожиданно поступает большое количество лекарства. Это может привести к созданию высоких и даже токсических концентраций лекарственного вещества в организме. Примерами препаратов, наиболее опасных в таких ситуациях, являются: сердечные гликозиды, антибиотики аминогликозидного ряда и противосудорожные средства. Применение внутрь гиперосмолярных растворов опасно развитием некротического энтероколита, но и в/в использование гиперосмолярных растворов может привести к таким же результатам. Поэтому применение 10% растворов глюкозы в/в в неонатологии как растворителя ограничено из за риска развития некротического энтероколита.
Поэтому применение 10% растворов глюкозы в/в в неонатологии как растворителя ограничено из за риска развития некротического энтероколита.
У новорождённых наблюдается повышенная проницаемость кожи, поэтому местное применение лекарств или их случайное попадание на тело ребёнка могут вызвать системные и токсические эффекты из-за всасывания препарата прямо через кожные покровы.
Свои особенности у детей, в том числе раннего возраста, имеет и распределение лекарств. Детский организм отличается повышенным содержанием воды, а соответственно и большим объёмом распределения, что требует коррекции доз лекарственных средств. У новорождённого вода составляет 70-75% массы тела, в то время как у взрослых этот показатель равен лишь 50-55%. Межтканевой жидкости у детей также больше — 40% от массы тела, по сравнению с 20% у взрослых. Это следует учитывать при определении дозировок.
У недоношенных новорождённых в возрасте менее 7 дней (беременность менее 34 недель) системный клиренс линезолида ниже, а значения AUC выше, чем у большинства новорождённых и детей. К 7 дню после рождения клиренс линезолида и значения AUC у недоношенных новорождённых приближается к таковым у доношенных новорождённых и детей. Отличительной особенностью фармакокинетики линезолида является очень хорошая тканевая проницаемость, более высокие концентрации препарата в тканях организма нежели в кровотоке, бактериостатический эффект.
К 7 дню после рождения клиренс линезолида и значения AUC у недоношенных новорождённых приближается к таковым у доношенных новорождённых и детей. Отличительной особенностью фармакокинетики линезолида является очень хорошая тканевая проницаемость, более высокие концентрации препарата в тканях организма нежели в кровотоке, бактериостатический эффект.
Другим фактором, влияющим на распределение лекарств, является их связывание с белками плазмы крови. Как правило, у новорождённых связывание с белками ослаблено, поэтому концентрация свободного препарата в плазме повышается. Поскольку именно свободное (несвязанное) вещество оказывает фармакологическое действие, это может привести к усилению действия лекарства или даже к проявлениям токсичности.
Биотрансформация большинства лекарств происходит в печени. У новорождённых и детей до 4 лет активность ферментов печени, ускоряющих и облегчающих превращение лекарств, более низкая, чем у взрослых, поэтому многие препараты медленно разрушаются и долго циркулируют в организме. Период полувыведения, который характеризует время нахождения лекарства в организме, у детей раннего возраста в 2-3 раза выше, чем у взрослых.
Период полувыведения, который характеризует время нахождения лекарства в организме, у детей раннего возраста в 2-3 раза выше, чем у взрослых.
Выведение лекарств из организма происходит главным образом с участием почек. Мочевыделительная система у новорождённых детей развита недостаточно, её функция достигает значений, характерных для взрослых (из расчёта на единицу площади поверхности тела), только к концу первого года жизни. Поэтому выведение лекарств почками у новорождённых происходит медленнее, чем у взрослых, что также учитывается при подборе дозы. На примере ванкомицина можно продемонстрировать, как снижается нефротоксичность препарата из-за незрелости канальцевой реабсорбции, таким образом, нефротоксичность ванкомицина у детей меньше, чем у взрослых у которых канальцевая реабсорбция способствует накоплению препарата в ткани почек, и реализация нефротоксичности происходит чаще.
Другой особенностью раннего детского возраста является незрелость гематоэнцефалического барьера, защищающего центральную нервную систему, что создаёт опасность проникновения лекарств из крови через этот барьер и, соответственно, повышает вероятность токсического воздействия на центральную нервную систему, которая и так еще не до конца сформировалась [14].
В основе высоких показателей заболеваемости и младенческой смертности до сегодняшнего дня лежат проблемы детей, родившихся раньше срока. Известно, что недоношенные дети подвержены высокому риску инфекционных осложнений. Особенно актуальными являются проблемы инфекционной патологии у незрелых детей в связи с изменением особенностей макроорганизма, что отражается на течении инфекционного процесса. Также происходит утяжеление течения фоновых состояний, создающих благоприятную основу для манифестации и прогрессирования инфекции, таких как: перинатальные поражения мозга, пневмопатии, врождённые пороки развития. В связи с увеличением количества детей с перинатальной патологией, существенно вырос процент новорождённых, состоящих в группе высокого риска по развитию бактериальных инфекций. В большинстве перинатальных центров новорождённым высокого риска проводится превентивная антибактериальная терапия: при любом подозрении на бактериальную инфекцию назначаются антибиотики.
Многие врачи-неонатологи считают, что раннее назначение антибиотиков широкого спектра действия предотвращает развитие гнойно-септического заболевания у детей с ослабленным иммунитетом и внутриутробно инфицированных. Большая часть детей, поступающих на выхаживание и лечение в палаты интенсивной терапии новорождённых, получает антибиотики с первого дня жизни. Как показывает практика, подобная тактика лечения не приводит к снижению частоты развития тяжёлых форм бактериальных инфекций. Более того, нерациональная антибактериальная терапия новорождённых имеет ряд негативных последствий. Бесконтрольное применение антибиотиков широкого спектра действия приводит к формированию антибиотикорезистентных штаммов микроорганизмов. При ослаблении иммунитета ребёнка эти микроорганизмы являются причиной тяжёлой бактериальной инфекции на фоне проводимой терапии. Кроме того, на сегодняшний день крайне ограничена информация о дозах применяемых антибактериальных препаратов у недоношенных новорождённых, сроках проведения антибактериальной терапии.
Большая часть детей, поступающих на выхаживание и лечение в палаты интенсивной терапии новорождённых, получает антибиотики с первого дня жизни. Как показывает практика, подобная тактика лечения не приводит к снижению частоты развития тяжёлых форм бактериальных инфекций. Более того, нерациональная антибактериальная терапия новорождённых имеет ряд негативных последствий. Бесконтрольное применение антибиотиков широкого спектра действия приводит к формированию антибиотикорезистентных штаммов микроорганизмов. При ослаблении иммунитета ребёнка эти микроорганизмы являются причиной тяжёлой бактериальной инфекции на фоне проводимой терапии. Кроме того, на сегодняшний день крайне ограничена информация о дозах применяемых антибактериальных препаратов у недоношенных новорождённых, сроках проведения антибактериальной терапии.
В доступной литературе нами найдены единичные исследования, посвящённые разработке и оценке режимов дозирования антибактериальных препаратов у глубоко недоношенных новорождённых.
В ретроспективном исследовании [8] по терапии неонатального сепсиса рассматривались результаты лечения колистином у новорождённых. Проведён анализ 21 случая лечения неонатального сепсиса. Диагноз сепсиса во всех случаях был подтверждён положительной гемокультурой и клиническими признаками сепсиса. Средний гестационный возраст и вес при рождении был 33 недели (26-39) и 1700 г (700-3600), соответственно. Девять новорождённых (43%) были с очень низкой массой тела при рождении. Восемнадцать новорождённых (86%) были недоношенные. Девятнадцать (91%) новорождённых детей выжили. Ни в одном случае не наблюдалось развития почечной недостаточности. Исследование показало, что колистин был эффективным и безопасным для лечения неонатального сепсиса, вызванного Acinetobacter с множественной лекарственной устойчивостью.
Итак, с учётом растущей частоты появления полирезистентных штаммов, нельзя ограничиваться отдельными схемами лечения. Необходимо постоянно опираться на фармакокинетические и фармакодинамические характеристики используемых препаратов. Кроме того, важно постоянно учитывать данные локального мониторинга этиологической структуры нозокомиальных инфекций в ОРИТ, антибиотико-резистентности проблемных патогенов.
В этой связи для оптимизации антибиотикотерапии у недоношенных новорождённых нами систематизированы режимы применения антибактериальных препаратов у этой группы детей в зависимости от гестационного возраста, массы тела и постконцептуального возраста [9-13] (табл. 1).
Выводы
Таким образом, лечение инфекционного процесса у недоношенных новорождённых представляет зачастую крайне сложную задачу, связанную как с анатомо-физиологической незрелостью макроорганизма, наличием фоновых состояний, так и недостаточными знаниями режима использования антибактериальных препаратов у детей разной степени недоношенности.
Проведение специальных исследований, направленных на изучение фармакокинетики антибактериальных препаратов и их дозирования будет способствовать повышению эффективности и безопасности их лечения, а также снижение риска селекции резистентных штаммов.
Продукция компании Фармасинтез | Создавая лекарства
Амивирен®
Ламивудин
150 мг300 мг
Лечение ВИЧ
ЖНВЛП
Противовирусное средство, нуклеозидный ингибитор обратной транскриптазы. Проникая в клетки, метаболизируется до 5-трифосфата, который ингибирует обратную транскриптазу ВИЧ, что приводит к угнетению репликации вирусов. Активен в отношении штаммов, устойчивых к зидовудину, а при применении в комбинации с ним замедляет развитие устойчивости вирусов к зидовудину (у пациентов, ранее не леченных). Противовирусное средство, нуклеозидный ингибитор обратной транскриптазы. Проникая в клетки, метаболизируется до 5-трифосфата, который ингибирует обратную транскриптазу ВИЧ, что приводит к угнетению репликации вирусов. Активен в отношении штаммов, устойчивых к зидовудину, а при применении в комбинации с ним замедляет развитие устойчивости вирусов к зидовудину (у пациентов, ранее не леченных).
Номер рег. удостоверения ЛП-002393
Производитель Фармасинтез
Форма выпуска таблетки
Case Based Pediatrics Глава
7-летний мальчик поступил в отделение неотложной помощи с лихорадкой и увеличивающейся областью покраснения над левой голенью. У него была лихорадка всего 8 часов с максимальной температурой 39 градусов по Цельсию. Три дня назад у него был укус жука на левую голень. Теперь он кажется инфицированным и болезненным. Гноя нет, но в течение ночи отмечается большая область покраснения с небольшой припухлостью. Из-за этих симптомов его доставили в отделение неотложной помощи.
Экзамен VS T 38.5, HR 90, RR 24, BP 100/65. Он бдителен и не токсичен. Его результаты обследования HEENT, сердца, легких и брюшной полости ничем не примечательны. Его левая нижняя конечность отрицательна на лимфангит или лимфаденопатию. Имеется овальная область эритродермии размером 6 на 12 см с резко очерченной границей над средней боковой стороной голени. Это центральная кожная язва, которая не кажется чрезмерно опухшей. Нет колебания или дренажа. В красной области присутствует легкая нежность.Нет костной болезненности, он может нормально передвигаться.
Получают культуру центрального поражения кожи. Также делается посев крови. Ему дали дозу клиндамицина внутривенно и прописали курс перорального приема клиндамицина. На следующий день его состояние улучшается. В его культуре кожных поражений вырастают бета-гемолитические стрептококки группы А. Его посев крови отрицательный. Его лечение антибиотиками заменено на пенициллин, и он полностью выздоравливает.
Антибиотики — один из наиболее важных классов лекарств, назначаемых врачами.Если вы рассмотрите основные классы фармакологических агентов, которые используются для лечения детей, вы обнаружите, что существует лишь несколько классов лекарств, которые используются часто. К ним относятся жаропонижающие / анальгетики, антибиотики, бронходилататоры и некоторые другие, менее распространенные, такие как кортикостероиды, анестетики, сердечные препараты и т. Д. Таким образом, из трех больших классов лекарств, которые часто используются для детей, антибиотики составляют основную группу. . Правильное назначение антибиотиков — важный навык медицинской практики.
Самая важная информация — уметь использовать антибиотик, который удовлетворительно излечивает пациента от инфекции. Хотя механизм действия различных антибиотиков важен, в большинстве случаев это не так важно. Антибиотикотерапия начинается тремя основными способами: 1) эмпирическая терапия, 2) специфическая терапия, 3) профилактика.
Эмпирическая терапия — это выбор лечения на основе клинической и лабораторной информации, за исключением данных о культуре и чувствительности.Специфическая терапия — это выбор антибиотика на основе посева и тестирования чувствительности организма, вызывающего инфекцию. Профилактика — это использование антибиотиков для предотвращения ожидаемой инфекции.
Эмпирическая терапия основана на трехэтапном процессе: 1) идентификация клинической сущности, 2) знание того, какие организмы вызывают эту сущность, 3) выбор антибиотика, который покрывает эти организмы. Некоторые врачи используют двухэтапный процесс, который заключается в идентификации клинического объекта, а затем выборе антибиотика, который обычно используется для этого объекта.Я бы предпочел, чтобы студенты и обучающиеся врачи изучали трехэтапный процесс, потому что это более глубокий уровень понимания. Трехэтапный метод — это универсальный подход, который всегда будет работать, поскольку в будущем мы столкнемся с изменениями в моделях устойчивости к противомикробным препаратам, новыми антибиотиками, ограничениями покрытия лекарств страховыми компаниями, профилями побочных эффектов, аллергией, проблемами соблюдения и т. Д. Двухэтапный процесс: это похоже на то, как если бы вы читали поваренную книгу, не понимая ее.
Многие студенты выучили простые правила выбора антибиотиков.К сожалению, простые правила обычно НЕ работают. Общепринятое правило состоит в том, что пенициллины и цефалоспорины (которые ингибируют синтез пептидогликана) действуют на грамположительные организмы, в то время как аминогликозиды (которые подавляют функцию бактериальных рибосом) действуют на грамотрицательные организмы. Часто это так, но это чрезмерное упрощение, у которого слишком много исключений, чтобы это правило было полезным. Это правило основано на предпосылке, что грамположительные организмы больше зависят от синтеза клеточной стенки пептидогликана (поэтому они окрашивают грамположительные), в то время как грамотрицательные организмы не так зависимы от синтеза клеточной стенки пептидогликана.Золотистый стафилококк — грамположительный организм, обладающий высокой устойчивостью к пенициллину. Золотистый стафилококк обычно чувствителен к пенициллинам и цефалоспоринам, устойчивым к пенициллиназе, но устойчивость к ним становится все более частой (25% и более). Аминогликозиды, такие как гентамицин, покрывают Staph aureus гораздо чаще, чем цефалоспорины. Neisseria gonorrhoeae — это грамотрицательный микроорганизм, для которого препаратом выбора является цефтриаксон. Neisseria gonorrhoeae раньше лечили пенициллином, но появление PPNG (Neisseria gonorrhoeae, продуцирующая пенициллиназу) сделало пенициллин неэффективным.Эпидермальный стафилококк — грамположительный организм, обладающий высокой устойчивостью к пенициллинам и цефалоспоринам. Staph epi обычно следует лечить ванкомицином.
Есть какие-нибудь простые правила, которые работают? К сожалению нет. Однако несомненно, что структура устойчивости к антибиотикам изменится, и будут разработаны новые антибиотики. Лучший способ изучить трехэтапный процесс — делать это часто. Если вы будете делать это снова и снова, это станет обычным и относительно простым делом.
В первую очередь обычно используется эмпирическая терапия. Справочники по антимикробной терапии общедоступны. Такое руководство предоставит полезную информацию для изучения трехэтапного процесса. Большинство справочников имеют три отдельных списка:
1. Список клинических инфекций и наиболее часто используемых антибиотиков при этих инфекциях.
2. Список клинических инфекций и обычных организмов, вызывающих эти инфекции.
3. Список организмов и их обычные образцы чувствительности и устойчивости (часто это таблица).Точно так же большинство больниц публикуют годовые процентные значения чувствительности и устойчивости микроорганизмов, выращенных в клинической лаборатории. Эти больничные результаты будут наиболее актуальными и специфичными для конкретных сообществ и моделей чувствительности и резистентности для организмов, которые, вероятно, будут влиять на ваших пациентов.
Первый список (№1 выше) представляет собой двухэтапный метод выбора антибиотиков. После идентификации клинической сущности можно выбрать антибиотик из этого списка.
Пункты № 2 и № 3, указанные выше, необходимы для трехэтапного метода. Хотя поначалу это может показаться более длительным процессом, он позволит учащимся и обучающимся врачам лучше понять, как использовать антибиотики. После частого использования трехэтапного метода вы станете очень хорошо в этом, и большинство решений по антибиотикам в будущем не потребуют помощи справочника. Трехэтапный процесс, описанный ниже:
Шаг 1. Идентификация клинического объекта.Анамнез и обследование предоставляют клиническую информацию. Иногда для большей уверенности в диагнозе может потребоваться лабораторная информация и информация о изображениях. Таким заболеванием может быть целлюлит, средний отит, пневмония, остеомиелит, гастроэнтерит, воспалительное заболевание органов малого таза, инфекция мочевыводящих путей, исключить сепсис и т. Д.
Шаг 2. Какие организмы вызывают это образование? Мы знаем, что в случае целлюлита наиболее распространенными микроорганизмами являются стрептококки группы А и золотистый стафилококк.
Шаг 3. Выберите антибиотик, который действует на организмы, потенциально вызывающие инфекцию. Стрептококк группы А чувствителен ко всем пенициллинам и цефалоспоринам. Золотистый стафилококк обычно чувствителен к цефалоспоринам и пенициллинам, устойчивым к пенициллиназе, таким как оксациллин и клоксациллин. Однако растет устойчивость к этим препаратам золотистого стафилококка (в настоящее время около 25% и более). Золотистый стафилококк примерно на 95% чувствителен к клиндамицину, и это также относится к стрептококкам группы А.Таким образом, клиндамицин в данном случае является лучшим выбором для лечения целлюлита. Еще одно соображение — серьезность инфекции. В случае опасной для жизни инфекции, такой как бактериальный менингит, должно быть гарантированное 100% покрытие. Таким образом, может потребоваться эмпирическое использование первоначального широкого спектра или нескольких антибиотиков. В отличие от менее серьезной инфекции, такой как средний отит или импетиго, в этом случае может быть достаточно 80% уверенности в охвате.
Это можно разделить дальше.Более опытный врач исследует целлюлит и указывает, что этот целлюлит вызван стрептококком группы А, который чаще вызывает эритродермию на больших участках вокруг единственной кожной язвы. Целлюлит Staph aureus обычно связан с нагноением и меньшей площадью покраснения и уплотнения вокруг центрального абсцесса. Таким образом, клинически можно быть более уверенным в том, что это стрептококковый целлюлит группы А, который можно лечить пенициллином. В данном случае пациенту первоначально вводили клиндамицин внутривенно, поскольку сразу же был достигнут высокий уровень антибиотиков, после чего был проведен курс перорального приема клиндамицина.Когда результаты посева вернулись, идентифицируя организм и его чувствительность к пенициллину, пациент мог быть переведен на специфическую терапию пенициллином.
Специфическая терапия использует информацию о культуре и чувствительности, которая обычно доступна через 1–3 дня. Общий принцип — выбрать наиболее эффективный антибиотик с наименьшими побочными эффектами. Кроме того, может быть предпочтительнее выбрать антибиотик с наиболее узким спектром, чтобы снизить вероятность значительного изменения нормальной флоры пациента.Иногда врачи могут быть ограничены вопросами стоимости и соблюдения. Например, может быть два возможных лечения; тот, который является B.I.D. стоимостью 80 долларов и еще один Q.I.D стоимостью 10 долларов. Один дешевле, но может быть труднее обеспечить соблюдение. Такие решения являются суждениями, которые врачи должны принимать в соответствии с предпочтениями пациентов.
Профилактика — это использование антибиотиков при ожидаемой инфекции. Примером может служить рана от укуса собаки, в которой через несколько дней ожидается заражение.Помимо очищения и промывания раны, антибиотики могут снизить риск инфицирования пациента. Пациенты с пузырно-мочеточниковым рефлюксом подвержены большему риску инфекций мочевыводящих путей. Таким образом, профилактическое лечение этих пациентов антибиотиками (обычно один или два раза в день) снизит их вероятность заражения ИМП. Пациенты с ревматической лихорадкой и последующей ревматической болезнью сердца подвергаются риску обострения сердечного заболевания в случае заражения другой стрептококковой инфекцией группы А.Таким образом, таким пациентам назначают ежедневные пероральные инъекции пенициллина или ежемесячные инъекции бензатин-пенициллина длительного действия для предотвращения стрептококковых инфекций группы А.
В будущем будут разработаны новые антибиотики. Предварительно антибиотики можно разделить на 7 групп: пенициллины, цефалоспорины, аминогликозиды, сульфаниламиды, хинолоны, макролиды и другие.
пенициллины
Пенициллины подавляют образование стенок бактериальных клеток, подавляя синтез пептидогликана.Пенициллины можно разделить на три группы: пенициллин, пенициллины широкого спектра действия и пенициллины против стафилококка. Пенициллин обычно охватывает стрептококки группы A и группы B, большинство пневмококков, Neisseria meningitidis, Pasteurella multocida, Listeria и большинство анаэробов (за исключением bacteroides fragilis). Пенициллины широкого спектра действия включают амоксициллин, ампициллин, карбенициллин, тикарциллин, пиперациллин, азлоциллин, мезлоциллин и т. Д. Эта группа охватывает больше грамотрицательных организмов, таких как E.coli, Proteus, Klebsiella и др. За исключением амоксициллина и ампициллина, другие пенициллины широкого спектра действия также охватывают псевдомонады. Пенициллины широкого спектра действия можно комбинировать с ингибиторами пенициллиназы, такими как клавуланат и сульбактам. Эти комбинированные препараты, такие как аугментин (амоксициллин / клавуланат), унасин (ампициллин / сульбактам), тиментин (тикарциллин / клавуланат) и зосин (пиперациллин / тазобактам), охватывают большинство стафилококков (но не MRSA) и других пенициллиназ-продуцирующих организмов. продуцирующая лактамазу Haemophilus influenzae B.
Следует отметить, что амоксициллин метаболизируется в ампициллин в кровотоке. Таким образом, эти два антибиотика имеют одинаковое покрытие. Амоксициллин лучше всасывается из желудочно-кишечного тракта, поэтому следует отдавать предпочтение амоксициллину при пероральном введении (за исключением инфекций желудочно-кишечного тракта), а не ампициллину, а ампициллин — при внутривенном введении (амоксициллин больше не доступен внутривенно).
Пенициллины против золотистого стафилококка также называются пенициллинами, устойчивыми к пенициллиназе, которые включают метициллин, оксациллин, нафциллин, клоксациллин, диклоксациллин.Эти препараты нацелены против золотистого стафилококка, поэтому эту группу точнее называть пенициллинами против золотистого стафилококка. Золотистый стафилококк, устойчивый к метициллину (MRSA), устойчив ко всем пенициллинам этой группы. Около 25% или более золотистого стафилококка в настоящее время являются MRSA. Термин «пенициллины, устойчивые к пенициллиназе» — неправильное употребление. Это правда, что золотистый стафилококк устойчив к пенициллинам из-за продукции пенициллиназы, но термин «пенициллиназы, устойчивые к пенициллиназе» подразумевает, что они будут охватывать все организмы, продуцирующие пенициллиназу, но они не охватывают продуцирующие пенициллиназу Neisseria gonorrhoeae, Haemophilus influenzae, Bacteroides many fragilis и другие организмы, продуцирующие пенициллиназу.Таким образом, эту группу более уместно называть пенициллинами против стафилококка, потому что единственным организмом, продуцирующим пенициллиназу, который они покрывают в умеренной степени, является золотистый стафилококк.
Цефалоспорины
Цефалоспорины структурно похожи на пенициллины с аналогичным механизмом действия. Цефалоспорины трудно выучить, потому что их много и часто вводятся новые. «Генерация» цефалоспоринов приносит лишь незначительную пользу.В целом, все цефалоспорины охватывают все чувствительные к пенициллину организмы, за исключением Listeria и Pasturella. Пенициллин лучше защищает от стрептококков группы B, чем цефалоспорины. Цефалоспорины также охватывают многие грамотрицательные организмы, такие как E. coli, Klebsiella, Proteus и т. Д. Цефалоспорины также охватывают золотистый стафилококк, но только в той же степени, что и пенициллины против стафилококка (т. Е. MRSA также устойчив к цефалоспоринам). Обычно верны два обобщения: 1) цефалоспорины более низких поколений покрывают стафилококк и стрептококковые инфекции лучше, чем цефалоспорины более высокого поколения (но покрытие стафилококка и стрептококка цефалоспоринами высокого поколения по-прежнему в целом адекватно), и 2) цефалоспорины более высоких поколений имеют более широкий охват грамотрицательных организмов.К сожалению, «поколение» цефалоспоринов не дает клиницистам особых свойств, которые позволяют нам использовать любое лекарство в том же поколении. В высших поколениях каждый цефалоспорин обладает определенными свойствами, которые делают один более полезным, чем другие. На мой взгляд, получение цефалоспоринов — НЕ лучший способ научиться применять цефалоспорины. Лучший способ выбрать цефалоспорины — изучить свойства одного цефалоспорина первого поколения, а затем найти другие полезные клинические свойства другого цефалоспорина, который дает клиницистам полезные клинические преимущества.Если цефалоспорин не имеет клинически полезных преимуществ, которые отличают его от других цефалоспоринов, то мы должны вычистить его из нашей памяти.
Прототипом цефалоспоринов первого поколения является цефазолин (торговые наименования Kefzol и Ancef), предназначенный для внутривенного введения. Цефалексин (торговое название Keflex) представляет собой пероральный цефалоспорин первого поколения с практически идентичным спектром. Эти препараты имеют базовое покрытие цефалоспорином, описанное выше.
Что делать, если нам необходимо страхование анаэробов? Затем мы использовали бы цефотетан (цефотан) или цефокситин (Мефоксин) внутривенно, поскольку эти цефалоспорины покрывают большинство анаэробов (но не 100%).Таким образом, эти цефалоспорины были бы предпочтительнее для профилактики аппендэктомии.
Что делать, если нам нужно страхование Haemophilus influenzae или Moraxella catarrhalis? Затем мы использовали бы цефуроксим (зинацеф), цефотаксим (клафоран) или цефтриаксон (роцефин) внутривенно. Мы также могли бы использовать пероральный цефуроксим (Цефтин) или цефаклор (Цеклор).
Что делать, если нам нужно покрыть менингит? Нам необходимо дополнительное свойство проникновения через гематоэнцефалический барьер в ЦНС и ЦСЖ. Хотя цефуроксим охватывает все микроорганизмы менингита, он НЕ проникает через гематоэнцефалический барьер так же, как цефотаксим и цефтриаксон, поэтому один из этих двух последних препаратов будет предпочтительнее.
Что делать, если нам нужна защита от псевдомонад? Затем мы использовали бы цефтазидим (Фортаз), поскольку это один из немногих цефалоспоринов с покрытием от псевдомонад.
Что, если бы мы хотели лечить инфекцию амбулаторно, но хотели быть уверены, что высокий уровень антибиотиков будет поддерживаться в течение как минимум 24 часов (аналогично госпитализации на ночь для внутривенного введения антибиотиков)? Затем мы использовали бы цефтриаксон (роцефин), поскольку он имеет длительный период полувыведения и его обычный интервал дозирования составляет каждые 12–24 часа.Таким образом, введение однократной дозы цефтриаксона в / м или в / в приводит к уровням антибиотиков, которые были бы аналогичны госпитализации в ночное время с внутривенным введением антибиотиков, но при существенно более низких затратах, поскольку это можно сделать в амбулаторных условиях.
Таким образом, для упрощения, единственными цефалоспоринами для внутривенного введения, которые нам необходимо знать для педиатрии, являются цефазолин (первое поколение), цефотетан (лучший охват анаэробов), цефтриаксон (расширенный охват, который включает Haemophilus influenzae и Moraxella, хорошее проникновение через гематоэнцефалический барьер и длительный срок действия) и цефтазидим (покрытие псевдомонад).Единственными оральными цефалоспоринами, которые нам необходимо знать, являются цефалексин (первое поколение), цефуроксим (расширенный охват) и, возможно, цефиксим (прием один раз в день часто рекомендуется при ИМП). Другие цефалоспорины менее важны. Мы все равно будем сталкиваться с ними, потому что их пропишут другие врачи, и есть дополнительные тонкие факторы, которые могут немного благоприятствовать другим цефалоспоринам. Но для большинства клинических применений этого будет достаточно.
Аминогликозиды
Аминогликозиды подавляют функцию бактериальных рибосом.Аминогликозиды более токсичны, чем пенициллины и цефалоспорины. Таким образом, их необходимо поддерживать в определенном терапевтическом диапазоне. Высокие уровни аминогликозидов нефротоксичны и ототоксичны. Эти препараты также являются слабыми нервно-мышечными блокаторами, поэтому они могут вызывать угнетение дыхания или апноэ при введении пациенту с нервно-мышечным нарушением (например, ранний детский ботулизм, синдром Гийена Барре, тяжелые миопатии и т. Д.).
Аминогликозиды обычно действуют против грамотрицательных организмов (особенно Enterobacteriacae, также известных как микробы стула).Однако аминогликозиды также охватывают грамположительные организмы, такие как Staph aureus и многие стрептококки. Фактически, в то время как Staph aureus может быть на 25% устойчивым к пенициллинам и цефалоспоринам против стафилококка, резистентность Staph aureus к аминогликозидам составляет 10% или меньше.
Гентамицин — самый основной аминогликозид. Другие аминогликозиды с расширенным охватом включают тобрамицин и амикацин. Обратите внимание на написание гентамицина по сравнению с тобрамицином. Разница в «мишени» (без «у»).Гентамицин обычно пишется с ошибками. Тобрамицин и амикацин имеют расширенное покрытие грамотрицательных бактерий, которое включает большинство псевдомонад.
сульфаниламиды
Большинство сульфаниламидов ингибируют различные этапы метаболических путей, например, метаболизм фолиевой кислоты. Популярный комбинированный препарат триметоприм-сульфаметоксазол подавляет метаболизм фолиевой кислоты в двух точках. Сульфаниламиды недороги и имеют широкий спектр. Сульфаниламиды обычно используются при грамотрицательных инфекциях, таких как инфекции мочевыводящих путей; однако они хорошо покрывают многие грамположительные результаты, такие как Staph aureus.Это идеальное сочетание эффективного широкого охвата и низкой стоимости, за исключением того, что сульфаниламиды имеют немного более высокий риск серьезных лекарственных реакций, таких как синдром Стивенса-Джонсона. Кроме того, сульфаниламиды вызывают острые гемолитические реакции у некоторых пациентов с дефицитом G6PD. Поскольку обычно мы не знаем, у кого дефицит G6PD, а синдром Стивенса-Джонсона может привести к смерти или серьезным заболеваниям, эти факторы снизили популярность сульфаниламидов. Судебные процессы с участием сульфаниламидов предполагают, что злоупотребление служебным положением происходит, когда врачи не предупреждают пациента о побочных реакциях, таких как гемолитические реакции и синдром Стивенса-Джонсона.Таким образом, если вы собираетесь прописать пациенту сульфонамид, вы должны сообщить ему об этих рисках (реакция крови, если у него есть скрытая проблема с кровью, или тяжелая аллергическая реакция, которая может привести к смерти). В большинстве случаев после того, как пациенты будут проинформированы о таких рисках, они предпочтут альтернативные антибиотики с аналогичным покрытием и меньшими побочными эффектами. В большинстве случаев другие антибиотики могут обеспечить такое же покрытие с меньшим риском и аналогичными затратами. Однако у пациентов с аллергией на другие антибиотики могут быть полезны сульфаниламиды.Кроме того, если в истории болезни пациента указано, что он без проблем использовал сульфонамид в прошлом, то риск побочной реакции у него значительно ниже.
Хинолоны
Этот класс антибиотиков структурно родственен налидиксовой кислоте. Эти препараты подавляют синтез бактериальной ДНК, ингибируя B-субъединицу ДНК-гиразы, важного фермента, который позволяет расслаблять и преобразовывать суперспирали ДНК. Хинолоны, такие как ципрофлоксацин, норфлоксацин и левофлоксацин, имеют очень широкий спектр действия против Staph aureus (включая MRSA), пневмококка, Haemophilus influenzae, микоплазмы, хламидиоза, грамотрицательных кишечных бактерий, Pseudomonas и т. Д.. Их основное показание — резистентные инфекции мочевыводящих путей, но их широкий спектр делает их эффективными при других состояниях. Их использование в педиатрии ограничено, поскольку в настоящее время они противопоказаны детям и беременным женщинам, поскольку эти препараты нарушают рост костей у лабораторных животных.
Карбапенемы
Этот новый класс антибиотиков нацелен на синтез клеточной стенки бактерий путем ингибирования ферментов транспептидазы, необходимых для сшивания пептидогликанов.Эти препараты очень широкого спектра действия похожи на цефалоспорины высокого поколения. Примеры включают имипенем и меропенем. Эти препараты обычно не используются в педиатрии, так как они чаще всего используются при высокорезистентных инфекциях у взрослых.
Макролиды и другие.
Типичным макролидом является эритромицин. Эти препараты подавляют функцию бактериальных рибосом. Эти препараты действуют на большинство стрептококков и некоторые золотистые стафилококки. Они также охватывают многие атипичные организмы, такие как микоплазмы, хламидии, легионеллы, бордетеллы, иерсинии, кампилобактеры и туляремия.Обычно используются этилсукцинат эритромицина (EES) и эстолат эритромицина (также известный как пропиллаурелсульфат эритромицина или илозон). EES менее токсичен для печени. Эстолат эритромицина достигает более высоких уровней в тканях и обычно рекомендуется при коклюше. Новые и более дорогие эритромицины, такие как азитромицин и кларитромицин, имеют более широкий охват, меньше побочных эффектов и более удобное дозирование. Азитромицин вводят один раз в день в течение 5 дней, чтобы обеспечить клиническую эффективность в течение 10 дней.
Семейство тетрациклинов (тетрациклин, доксициклин, миноциклин и др.) разделяет некоторые свойства с эритромицинами в том, что они подавляют функцию бактериальных рибосом и охватывают многие из тех же атипичных организмов. Тетрациклины, как правило, являются фотосенсибилизаторами, что ограничивает их использование на Гавайях. Детям не рекомендуется применять тетрациклин, поскольку он вызывает окрашивание зубов, гипоплазию зубной эмали и аномальный рост костей у детей.
Ванкомицин — гликопептид, подавляющий синтез клеточной стенки бактерий. Он доступен для внутривенного введения, так как не всасывается из желудочно-кишечного тракта.Ванкомицин обладает широким спектром действия, и его основное применение в педиатрии заключается в лечении резистентного золотистого стафилококка (MRSA) и резистентных пневмококков. Использование ванкомицина связано с «синдромом красного человека», который представляет собой гистаминоподобную реакцию, которую можно подавить предварительной обработкой дифенгидрамином и замедлением скорости внутривенного введения ванкомицина. Ванкомицин также можно назначать перорально при псевдомембранозном колите, вызванном Clostridium difficile.
Клиндамицин подавляет бактериальную рибосомную функцию.Он охватывает большинство стрептококков и золотистого стафилококка. Клиндамицин покрывает большую часть MRSA, но не на 100%. Если требуется 100% охват от золотистого стафилококка, то показан ванкомицин. Клиндамицин полезен для амбулаторного лечения целлюлита и других инфекций, обычно вызываемых стрептококком группы А и золотистым стафилококком. Устойчивость золотистого стафилококка к клиндамицину присутствует, но встречается редко. Многие врачи лечат целлюлит и другие предполагаемые амбулаторные состояния, связанные с золотистым стафилококком, с помощью клиндамицина вместо цефалоспоринов, поскольку слишком часто возникает резистентность к цефалоспоринам.Клиндамицин также используется для лечения анаэробов, включая Bacteroides fragilis.
Хлорамфеникол подавляет бактериальную рибосомную функцию. Хлорамфеникол используется нечасто, поскольку он может вызвать необратимое подавление костного мозга. Чаще он вызывает обратимое угнетение костного мозга, которое не так серьезно. Хлорамфеникол охватывает все анаэробы, аналогичные клиндамицину. Хлорамфеникол хорошо проникает через гематоэнцефалический барьер и проникает в ликвор, поэтому его часто использовали для лечения менингита.Хлорамфеникол обладает необычным свойством достигать высоких уровней в сыворотке крови при пероральном приеме. Большинство других препаратов требуют внутривенного введения для получения высоких уровней в сыворотке. Когда я был резидентом в начале 80-х, все дети с бактериальным менингитом сначала лечились ампициллином и хлорамфениколом. Если организм был устойчив к ампициллину, то можно было бы использовать хлорамфеникол. Этих детей действительно можно было перевести на пероральный прием хлорамфеникола, если было трудно начать внутривенное введение.Общий анализ крови будет проверяться ежедневно или через день, чтобы проверить подавление костного мозга. Цефалоспорины и ванкомицин в значительной степени заменили эти старые препараты для лечения менингита.
Метронидазол (Флагил) — антипаразитарный антиамебный препарат, но он также почти полностью покрывает анаэробы. Таким образом, когда требуется 100% охват анаэробами, варианты включают метронидазол, клиндамицин или хлорамфеникол. Пенициллины широкого спектра действия в сочетании с клавуланатом или сульбактамом также могут в достаточной степени покрывать анаэробы.
Вопросы
1. Сколько существует поколений цефалоспоринов?
2. Может ли образование цефалоспорина (само по себе) быть единственным критерием выбора для конкретной клинической ситуации?
3. Перечислите некоторые организмы, вызывающие следующие заболевания: остеомиелит, бактериальный менингит.
4. Какой эмпирический антибиотик (ы) можно было бы использовать для защиты организмов, указанных в приведенном выше вопросе?
5.Выберите эмпирический антибиотик для 10-летней девочки с небольшой пневмонией на рентгенограмме грудной клетки. У нее нет лихорадки, частый непродуктивный кашель.
6. Выбрать эмпирический антибиотик для 18-месячной женщины с лихорадкой и пиурией на UA (т. Е. С подозрением на ИМП)?
7. Вы решили прописать пациенту эритромицин. Вы можете назначить эритромицин этилсукцинат (EES), который стоит 10 долларов за 40 таблеток (1 таблетка четыре раза в день в течение 10 дней), или вы можете прописать азитромицин (Zithromax), который стоит 70 долларов за 6 таблеток (две таблетки сегодня, затем по одной таблетке ежедневно в течение еще 4 дней). ).Какие соображения следует учитывать при принятии такого решения?
Список литературы
1. Beers MH, Berkow R (ред.). Руководство по диагностике и терапии Merck, семнадцатое издание, столетнее издание. 2001 г., Интернет-издание, предоставленное MEDICAL SERVICES, USMEDSA, США. www.merck.com/pubs/mmanual
Ответы на вопросы
1 и 2. Их как минимум четыре, а возможно, пять, а возможно и шесть. Несомненно, в будущем их будет больше.Чем эти цефалоспорины отличаются друг от друга и по какой характеристике они принадлежат к определенному поколению? Ответить на этот вопрос непросто. Если вы введете «цефалоспорин четвертого поколения» в поисковую систему Medline, вы найдете несколько статей о цефалоспоринах четвертого поколения. Точно так же поиск цефалоспоринов пятого и шестого поколения дает некоторые статьи. Если бы я был ловким продавцом лекарств, я бы просто назвал свой новый цефалоспорин «десятым поколением», и почти все его купили бы.Однако какая особенность цефалоспоринов делает его клинически полезным по сравнению с другими цефалоспоринами? Если лекарство представляло собой цефалоспорин десятого поколения, но не имело клинических преимуществ перед существующим цефалоспорином третьего поколения, то в таком цефалоспорине десятого поколения нет необходимости. Генерация не так важна, как конкретное свойство цефалоспорина, которое делает его клинически полезным по сравнению с другим цефалоспорином.
3. Остеомиелит: наиболее вероятен золотистый стафилококк.Бактериальный менингит: пневмококк, менингококк, Haemophilus influenzae типа B (HiB).
4. При остеомиелите мы могли бы покрыть Staph aureus пенициллином против Staph aureus, таким как оксациллин, нафциллин или метициллин, или цефалоспорином первого поколения, таким как цефазолин. Однако в настоящее время устойчивость к этим препаратам составляет от 25% до 30%. Хотя есть большая вероятность, что пациент ответит, в 25–30% случаев это лечение будет неэффективным, и пациент будет страдать от последствий неадекватного лечения, которые включают: смерть от сепсиса, стафилококковую пневмонию, распространение остеомиелита, хронический остеомиелит, требующий ампутации и др.Ни одно из этих осложнений не является незначительным, поэтому 75% охват недостаточен. Эмпирически необходимо 100% покрытие, поскольку остеомиелит — серьезная инфекция. Таким образом, в данном случае предпочтительным методом лечения является внутривенное введение ванкомицина. В случае бактериального менингита нам нужен антибиотик, чтобы эффективно покрывать эти организмы, и, кроме того, нам нужен антибиотик, который проникает через гематоэнцефалический барьер в спинномозговую жидкость. Здесь подойдет хлорамфеникол, но мы не используем его из-за его побочных эффектов.Цефтриаксон или цефотаксим, вводимые внутривенно, хорошо проникают в спинномозговую жидкость и покрывают менингококк, HiB и большинство пневмококков, но пневмококк имеет небольшую частоту высокого уровня устойчивости к цефалоспоринам, поэтому необходимо добавить ванкомицин.
5. Какой организм наиболее вероятен? Микоплазма или вирусная. Пневмококк маловероятен, так как у нее нет лихорадки. Лучшим антибиотиком будет эритромицин.
6. Хотя триметоприм / сульфаметоксазол (Бактрим или Септра) обычно рекомендуется из-за его широкого охвата для этого показания, этот препарат вызывает синдром Стивенса-Джонсона чаще, чем другие.Если родители соглашаются с этим повышенным риском, это следует зафиксировать в таблице. Большинство родителей не желают принимать этот повышенный риск, поскольку доступны другие антибиотики. Амоксициллин, вероятно, подействует, но существует высокая частота резистентности, которая, как правило, не характерна для простого цистита, но у 18-месячного возраста с лихорадкой также может быть некоторая степень пиелонефрита. Устойчивость к цефалоспоринам встречается нечасто. Таким образом, приемлемым ответом здесь также будет цефалоспорин первого поколения, такой как цефалексин.Цефтриаксон внутримышечно можно также назначить при первичном обращении к пациенту, чтобы обеспечить высокие начальные уровни антибиотиков и начальную комплаентность.
7. Стоимость, комплаентность, удобство, эффективность и т. Д. Хотя EES составляет 10 долларов, а азитромицин — 70 долларов, некоторые пациенты могут предпочесть платить больше, если более дорогое лекарство имеет значительные преимущества. Кроме того, поскольку у большинства пациентов есть планы приема лекарств, разница может быть незначительной (например, 5 долларов против 10). Соблюдение режима лечения необходимо для того, чтобы лекарство было эффективным. EES необходимо принимать четыре раза в день в течение 10 дней, а азитромицин — один раз в день в течение пяти дней.Кроме того, EES может иметь больше побочных эффектов со стороны желудочно-кишечного тракта. Очевидно, что прием лекарства один раз в день удобнее, чем прием внутрь. медикамент. Если оба препарата эффективны, возможно, лучше всего обсудить эти различия с пациентом и внести свой вклад в принятие решения.
Вернуться к содержанию
Домашняя страница факультета педиатрии Гавайского университета
Пенициллины, цефалоспорины, гликопептиды, макролидные антибиотики, аминогликозиды, противотуберкулезные средства, противовирусные средства, вакцины
Автор
Мухаммад Васим, MS, MBBS, FAAP, FACEP, FAHA Профессор неотложной медицины и клинической педиатрии, Медицинский колледж Weill Cornell; Лечащий врач отделения неотложной медицины и педиатрии, Линкольнский медицинский и психиатрический центр; Адъюнкт-профессор экстренной медицины, адъюнкт-профессор педиатрии, Медицинский факультет Университета Святого Георгия, Гренада
Мухаммад Васим, магистр медицины, MBBS, FAAP, FACEP, FAHA является членом следующих медицинских обществ: Американская академия педиатрии, Американская академия Неотложная медицина, Американский колледж врачей неотложной помощи, Американская кардиологическая ассоциация, Американская медицинская ассоциация, Ассоциация специалистов в области клинических исследований, Общественная ответственность в медицине и исследованиях, Общество академической неотложной медицины, Общество моделирования в здравоохранении
Раскрытие информации: раскрывать нечего.
Соавтор (ы)
Marie-Micheline Lominy, MD Лечащий врач, Медицинский центр Линкольна; Врач детской подростковой медицины, Бостонские врачи по детскому здоровью
Мари-Мишлин Ломини, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Гаитянской медицинской ассоциации за рубежом, Общества Красного Креста Гаити
Раскрытие: Ничего не разглашать.
Главный редактор
Russell W. Steele, доктор медицины Клинический профессор, медицинский факультет Тулейнского университета; Врач-штатный врач, Ochsner Clinic Foundation
Рассел Стил, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологии, Американского общества инфекционных болезней, Медицинского центра штата Луизиана. Общество, Общество детских инфекционных болезней, Общество педиатрических исследований, Южная медицинская ассоциация
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Джозеф Домачовске, доктор медицины Профессор педиатрии, микробиологии и иммунологии, кафедра педиатрии, отделение инфекционных заболеваний, Медицинский университет штата Нью-Йорк
Джозеф Домачовске, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha , Американская академия педиатрии, Американское общество микробиологии, Общество инфекционных болезней Америки, Общество педиатрических инфекционных болезней, Phi Beta Kappa
Раскрытие: Получен грант на исследования от: Pfizer; GlaxoSmithKline; AstraZeneca; Merck; Американской академии педиатрии, Novavax, Regeneron , Diassess, Actelion
Полученный доход в размере 250 долларов США или более от: Sanofi Pasteur.
Николас Джон Беннетт, MBBCh, PhD, FAAP, MA (Cantab) Доцент педиатрии, содиректор отдела управления противомикробными препаратами, медицинский директор, Отделение детских инфекционных заболеваний и иммунологии Детского медицинского центра Коннектикута
Николас Джон Беннетт, MBBCh, PhD, FAAP, MA (Cantab) является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия педиатрии
Раскрытие информации: получил исследовательский грант от: Cubist
Полученный доход в размере не менее чем 250 долларов от: Horizon Pharmaceuticals, Shire
Юридические консультации по вопросам Medico: Разн.
Благодарности
Лесли Л. Бартон, доктор медицины Почетный профессор педиатрии, Медицинский колледж Университета Аризоны
Лесли Л. Бартон, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Ассоциации директоров детских программ, Американского общества инфекционных болезней и Общества педиатрических инфекционных болезней
Раскрытие: Ничего не нужно раскрывать.
Хайди Коннолли, доктор медицины Адъюнкт-профессор педиатрии и психиатрии, Школа медицины и стоматологии Рочестерского университета; Директор, Служба детской медицины сна, Центр сильных расстройств сна
Раскрытие: Ничего не нужно раскрывать.
Брент Р. Кинг , доктор медицины, МММ Клайв Нэнси и Пирс Раннеллс Заслуженный профессор экстренной медицины; Профессор педиатрии Центра медицинских наук Техасского университета в Хьюстоне; Заведующий отделением неотложной медицины, начальник отделения неотложной помощи, больница Мемориал Германн и больница LBJ
Раскрытие: Ничего не нужно раскрывать.
Джефф Л. Майерс, доктор медицины, доктор философии Заведующий отделением детской и врожденной кардиохирургии, хирургическое отделение, Массачусетская больница общего профиля; Доцент хирургии Гарвардской медицинской школы
Раскрытие: Ничего не нужно раскрывать.
Марк И. Нойман, доктор медицины, магистр здравоохранения Доцент педиатрии Гарвардской медицинской школы; Лечащий врач отделения неотложной медицинской помощи, Детская больница Бостон
Mark I Neuman, MD, MPH является членом следующих медицинских обществ: Society for Pediatric Research
Раскрытие: Ничего не нужно раскрывать.
Хосе Рафаэль Ромеро, доктор медицины Директор программы стипендий по педиатрическим инфекционным заболеваниям, доцент кафедры педиатрии Объединенного отделения детских инфекционных заболеваний, Университет Крейтон / Медицинский центр Университета Небраски
Хосе Рафаэль Ромеро, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американского общества микробиологов, Американского общества инфекционных болезней, Нью-Йоркской академии наук и Общества педиатрических инфекционных болезней
Раскрытие: Ничего не нужно раскрывать.
Маника Сурьядевара, доктор медицины Научный сотрудник по педиатрическим инфекционным заболеваниям, педиатрический факультет, Медицинский университет штата Нью-Йорк, штат Нью-Йорк,
Раскрытие: Ничего не нужно раскрывать.
Isabel Virella-Lowell, MD Отделение педиатрии, отделение легочных заболеваний, детской пульмонологии, аллергии и иммунологии
Раскрытие: Ничего не нужно раскрывать.
Гарри Уилкс, MBBS, FACEM Директор отделения неотложной медицины, Госпиталь на Голгофе, Канберра, АКТ; Адъюнкт-профессор, Университет Эдит Коуэн, Западная Австралия
Раскрытие: Ничего не нужно раскрывать.
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Ничего не нужно раскрывать.
Грейс М. Янг, доктор медицины Доцент кафедры педиатрии, Медицинский центр Университета Мэриленда
Раскрытие: Ничего не нужно раскрывать.
Многократное назначение антибиотиков детям от 0 до 5 лет в зависимости от вида антибиотик | Журнал антимикробной химиотерапии
Аннотация
Был исследован риск получения более одного рецепта в рамках курса антибиотиков. для всех детей в возрасте от 0 до 5 лет в датском графстве в 1997 году.Мы выявили 29 307 рецепты системных антибиотиков для 16 245 детей в базе данных рецептов. Десять процентов из рецептов последовали новые рецепты в течение 10 дней. У детей, которые получили два рецепта ( n = 3993), 19% выкупили рецепты в течение тот же курс. Когда ребенку прописали пенициллин V, по сравнению с широким спектром действия пенициллин, отношение шансов получить повторный рецепт в течение 1-2 дней составило 2,9 (95% CI 2.5–3,4) и в течение 3–10 дней 1,3 (95% ДИ 1,2–1,5).
Введение
Знания о схемах выписывания рецептов необходимы для повышения качества выписывания рецептов. 1 Двенадцать процентов датских детей младше 3 лет получил не менее трех назначений системных антибиотиков в течение года. 2 Несколько исследований проанализировали, насколько вызванные различными инфекциями или риск получения более одного рецепта на один Курс антибиотиков зависит от вида антибиотика. 3
Мы определили рецепты системных антибиотиков для всех детей в возрасте 0–5 лет в Округ Северная Ютландия, Дания, в 1997 году. Конкретные цели заключались в следующем: (i) проанализировать типы прописанные антибиотики и оценить количество рецептов на ребенка, (ii) оценить количество курсов антибиотиков на ребенка в год по отношению к общему количеству рецептов и (iii) для оценки риска получения повторного рецепта в течение 0–10 дней в отношении тип антибиотика.
Материалы и методы
Настройка
Мы выявили все компенсируемые рецепты на системные антибиотики для детей в возрасте 0–5 лет с 1 января 1997 г. по 31 декабря 1997 г. в графстве Северная Ютландия. На На 1 января 1997 года население округа составляло 492 348 человек (что составляет около 9% от общей численности населения). датское население), в том числе 38 074 ребенка в возрасте 0–5 лет. Более 98% Население Дании находится на учете у терапевта и получает бесплатную медицинскую помощь.В Национальная служба здравоохранения Дании предоставляет всем гражданам медицинское обслуживание, поддерживаемое налогами, и возмещает 50–75% стоимости большинства прописанных лекарств. Данные передаются из Национальная служба здравоохранения к базе данных фармакоэпидемиологических рецептов округа Северной Ютландии, описанный в другом месте. 2
Антибиотики в Дании приобретаются только по рецепту, но в базе данных нет информация о лекарствах, не субсидируемых Национальной службой здравоохранения, в том числе цефалоспорины и тетрациклины.Влияние компенсации в этом исследовании незначительно. потому что цефалоспорины составляли только 0,2% от общих установленных суточных доз продаваемых антибиотиков в округе в течение 1996 г. тетрациклины не применялись для детей младше 12 лет. 4 , 5
Анализы
Мы идентифицировали все рецепты на системные антибиотики (код ATC J01), разделенные на четыре группы: пенициллины широкого спектра действия (амоксициллин / пивампициллин / ампициллин / амоксициллин с ингибитор ферментов / бакампициллин / амидинопенициллин), пенициллин V, макролиды и прочее: сульфонамидсодержащие противоинфекционные препараты, другие пенициллины (диклоксациллин / флуклоксациллин), хинолоны и фузидиевая кислота.Возраст относится к возрасту ребенка на момент покупки первого рецептов в 1997 году.
Дни между назначениями для каждого ребенка были рассчитаны и сгруппированы: новых нет по рецепту, 0–2 дня, 3–10 дней и более 10 дней. Повторный рецепт был определен как рецепт, которому предшествовал рецепт в течение 0–10 дней (один антибиотик курс). При оценке риска повторного назначения в зависимости от типа антибиотика 949 рецепты были исключены, потому что они были куплены в тот же день, и у нас не было информация о том, какой рецепт был приобретен первым.Распределение групп антибиотиков был равен в исключенных и включенных рецептах.
Статистический анализ
Мы рассчитали отношение шансов (OR), чтобы оценить связь между типами антибиотиков. (пенициллин V, пенициллин широкого спектра действия) и повторить рецепт в течение 1-2 или 3-10 лет. дней (да / нет). OR были скорректированы с учетом возраста и пола в анализе логистической регрессии с использованием SPSS 8.0. Возраст был включен в модель как категориальная переменная: 0–1, 2–3 и 4–5 лет.Регулировка способа дозирования, то есть таблетки или жидкость, не изменила оценки риска и не были включены в окончательную модель.
Результаты
Выявлено 29 307 назначений системных антибиотиков для 16 245 детей в возрасте. 0–5 лет, из которых 53% составляли мужчины. Пенициллины широкого спектра действия составили 49%, пенициллин V 38%, макролиды 10% и прочие 3% от рецептов.
У детей, которым были назначены антибиотики, 56% получали один, 24% получали два и 20% получили три и более рецепта.Дети, получившие не менее трех рецептов в основном дети младшего возраста, т.е. 28% детей в возрасте до 1 года по сравнению с 13% детей в возрасте до 1 года. 5-летние.
Оценка количества курсов антибиотиков
В целом, 16 245 рецептов не сопровождались новым назначением, 1380 (5%) были с последующим повторным назначением в течение 0–2 дней, 1426 (5%) в течение 3–10 дней и 10 256 (35%) в течение 10–354 дней. Доля пенициллинов широкого спектра действия составляла выше в повторных рецептах (53%) по сравнению с первоначальными рецептами (37%).В таблице I показано количество курсов антибиотиков на одного ребенка по отношению к общее количество рецептов на каждого ребенка.
Риск повторного назначения врача
Риск в течение 1-2 дней был почти трехкратным при назначении пенициллина V, по сравнению с пенициллином широкого спектра действия (Таблица II). Амоксициллин и пивампициллин составлял 86% пенициллинов широкого спектра действия. Для пивампициллина OR для получение повторного рецепта в течение 1-2 дней и 3-10 дней по сравнению с амоксициллин, было 2.8 (95% ДИ 1,9–4,2) и 1,8 (95% ДИ 1,4–2,4) соответственно. Нет Было обнаружено различие между различными собственными названиями амоксициллина.
Таблица II показывает риск получения повторного рецепта на пять различные патентованные названия пенициллина V, который составляет 99% проданного пенициллина V. Все типы выпускаются как в виде таблеток, так и в виде жидкости.
Обсуждение
Большая часть детей получила более одного рецепта на один антибиотик. курс.Это было более вероятно, если ребенку изначально был прописан пенициллин V, по сравнению с с антибиотиками широкого спектра действия.
Основными сильными сторонами нашего исследования являются его большой размер, популяционный дизайн и данные качество. К недостаткам можно отнести отсутствие информации о показаниях к назначению и продолжительность лечения. Кроме того, уровень отсечения при определении повторного рецепта (0–10 дней) для курса антибиотиков является произвольным, хотя клинически значимым.
Наши данные подтверждают другие отчеты о лечении инфекций, требующих применения более одного антибиотика. рецепт. 3 Количество рецептов кажется незначительным. неточное измерение количества инфекций, перенесенных антибиотиками в детском возрасте. Это должно быть учитывается при сравнении использования антибиотиков в разных странах, так как закономерности повторения рецепты могут отличаться. Детям назначают многократные назначения антибиотиков. для разных эпизодов инфекций или неоднократно для одной и той же инфекции, т.е.е. один острый эпизод или как профилактическое средство. Последнее не распространено в Дании, и мы нашли только 23 лица с 10 рецептами и более.
Повторные назначения с интервалом 0–2 дня могут рассматриваться как избыточное назначение. Разница в риске в этот период по сравнению с 3–10 днями говорит о том, что проблема по всей видимости, это простота введения и соблюдение режима лечения, а не эффективность лекарства. Более того, больший риск повторного назначения пенициллина V по сравнению с препаратами широкого спектра действия. пенициллины согласуются с исследованиями вкусовых качеств суспензий противомикробных препаратов; амоксициллин и среди пенициллинов предпочтение отдавалось ампициллину. 6 вариации внутри патентованных наименований пенициллина V подчеркивают важность принятия; однако анализы не выявили какой-либо конкретной тенденции в отношении вкуса или рецептуры.
В нашем исследовании повторные назначения приводят к увеличению использования антибиотиков широкого спектра действия. во-первых потому что повторный рецепт чаще всего представляет собой препарат широкого спектра действия, а во-вторых, потому что предыдущий опыт применения препарата может повлиять на выбор препарата в будущем. 7 Увеличение использования антибиотиков оказывает селективное давление на устойчивые штаммы среди бактерий. 8 , 9 скорость, с которой развивается резистентность, увеличивается при чрезмерном назначении, применении препаратов широкого спектра действия и плохое соблюдение. 10
Повторный рецепт увеличивает затраты на лечение как для пациента, так и для системы здравоохранения из-за расходов, связанных с повторными рецептами и посещениями врача. 3 Увеличение периода лечения может увеличить частоту побочные эффекты и вообще антибиотики широкого спектра действия имеют наибольшую частоту побочных эффектов. 5
Датские руководящие принципы рекомендуют пенициллин V в качестве препарата первого выбора для лечения дыхательных путей. инфекции во всех возрастных группах. 5 Пенициллин V недорогой и имеет низкий риск резистентности, но наше исследование указывает на некоторый повышенный риск чрезмерного назначения. Мы предложить повышенное внимание к вопросу соблюдения для сохранения ограничительной политики в отношении антибиотиков в Дания, а также продвигает это в других странах. Отмеченная вариация в разных патентованные названия пенициллина V подчеркивают необходимость фармацевтической промышленности улучшить свои усилия по производству хорошо переносимых продуктов.
Таблица I.Многократные назначения детям в возрасте от 0 до 5 лет в течение 1997 года. показано количество курсов антибиотиков для детей общим количеством 2, 3, 4 или 5 рецепты
| . | Курсы антибиотиков (% детей) . | . | ||||||
|---|---|---|---|---|---|---|---|---|
| № дети . | №из рецепты . | 1 . | 2 . | 3 . | 4 . | 5 . | Итого . | |
| 3993 | 2 | 19 | 81 | — | — | — | 100 | |
| 1752 32 | 3 | 3 | 5 | — | 100 | |||
| 803 | 4 | 1 | 11 | 36 | 52 | — | 100 | |
| 322 | 1 | 9040 9 904039 | 100 | |||||
| . | Курсы антибиотиков (% детей) . | . | ||||||
|---|---|---|---|---|---|---|---|---|
| № дети . | № рецепты . | 1 . | 2 . | 3 . | 4 . | 5 . | Итого . | |
| 3993 | 2 | 19 | 81 | — | — | — | 100 | |
| 1752 32 | 3 | 3 | 5 | — | 100 | |||
| 803 | 4 | 1 | 11 | 36 | 52 | — | 100 | |
| 322 | 1 | 9040 9 904039 | 100 | |||||
Множественные рецепты для детей в возрасте от 0 до 5 лет в течение 1997 года. показано количество курсов антибиотиков для детей общим количеством 2, 3, 4 или 5 рецепты
| . | Курсы антибиотиков (% детей) . | . | ||||||
|---|---|---|---|---|---|---|---|---|
| № дети . | № рецепты . | 1 . | 2 . | 3 . | 4 . | 5 . | Итого . | |
| 3993 | 2 | 19 | 81 | — | — | — | 100 | |
| 1752 32 | 3 | 3 | 5 | — | 100 | |||
| 803 | 4 | 1 | 11 | 36 | 52 | — | 100 | |
| 322 | 1 | 9040 9 904039 | 100 | |||||
| . | Курсы антибиотиков (% детей) . | . | ||||||
|---|---|---|---|---|---|---|---|---|
| № дети . | № рецепты . | 1 . | 2 . | 3 . | 4 . | 5 . | Итого . | |
| 3993 | 2 | 19 | 81 | — | — | — | 100 | |
| 1752 32 | 3 | 3 | 5 | — | 100 | |||
| 803 | 4 | 1 | 11 | 36 | 52 | — | 100 | |
| 322 | 1 | 9040 9 904039 | 100 | |||||
Риск получения повторного назначения любого системного антибиотика в течение 1-2 или 3–10 дней, если ребенку выписали пенициллин широкого спектра действия или пенициллин V
| . | Повторите рецепт в течение 1-2 дней . | Повторите рецепт в течение 3–10 дней . | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Подгруппа антибиотиков . | Рецепты . | (%) a . | Прил. ОШ (95% ДИ) b . | (%) a . | Прил. ОШ (95% ДИ) b . | ||||||
| a Процент выписанных рецептов с последующим повторным назначением. | |||||||||||
| b ИЛИ с поправкой на возраст и пол. Логистическая регрессия. 95% ДИ. | |||||||||||
| c Распределены по частоте продаж. | |||||||||||
| Пенициллин широкого спектра действия (эталон) | 13,947 | 1.8 | 1 | 4,3 | 1 | ||||||
| Пенициллин V | 10,737 | 4,7 | 2,9 (2,5–3,4) | 5,3 | 1,3 (1,2–1,5) | собственный c | |||||
| Calcipen (справочный) | 4608 | 3,1 | 1 | 4,8 | 8 | 1,3 (1,0–1,8) | 6,4 | 1,4 (1,1–1,8) | |||
| Вепикомбин | 1641 | 6,1 | 2,1 (1,6–2,7) | 4,8 | 1,0 (0,7–1) | ||||||
| Аципен Солютаб | 1558 | 6,5 | 2,4 (1,8–3,0) | 5,1 | 1,1 (0,9–1,4) | ||||||
| Примциллин | 1132 | 6.3 | 1,3 (1,0–1,8) | ||||||||
| . | Повторите рецепт в течение 1-2 дней . | Повторите рецепт в течение 3–10 дней . | |||
|---|---|---|---|---|---|
| Подгруппа антибиотиков . | Рецепты . | (%) a . | Прил. ОШ (95% ДИ) b . | (%) a . | Прил. ОШ (95% ДИ) b . |
| a Процент выписанных рецептов с последующим повторным назначением. | |||||
| b ИЛИ с поправкой на возраст и пол. Логистическая регрессия. 95% ДИ. | |||||
| c Распределены по частоте продаж. | |||||
| Пенициллин широкого спектра действия (эталон) | 13,947 | 1,8 | 1 | 4.3 | 1 |
| Пенициллин V | 10,737 | 4,7 | 2,9 (2,5–3,4) | 5,3 | 1,3 (1,2–1,5) |
| Пенициллин | c (собственный)|||||
| Calcipen (ссылка) | 4608 | 3,1 | 1 | 4,8 | 1 |
| Rocilin 409 | 481,3 (1,0–1,8) | 6,4 | 1,4 (1,1–1,8) | ||
| Вепикомбин | 1641 | 6,1 | 2,1 (1,6–2,7) | 4,8 | 1,0 (0,7–1) |
| Аципен Солютаб | 1558 | 6,5 | 2,4 (1,8–3,0) | 5,1 | 1,1 (0,9–1,4) |
| Примциллин | 1132 | 6.3 | 1,3 (1,0–1,8) | ||
Риск получения повторного назначения любого системного антибиотика в течение 1-2 или 3–10 дней, если ребенку выписали пенициллин широкого спектра действия или пенициллин V
| . | Повторите рецепт в течение 1-2 дней . | Повторите рецепт в течение 3–10 дней . | |||||
|---|---|---|---|---|---|---|---|
| Подгруппа антибиотиков . | Рецепты . | (%) a . | Прил. ОШ (95% ДИ) b . | (%) a . | Прил. ОШ (95% ДИ) b . | ||
| a Процент выписанных рецептов с последующим повторным назначением. | |||||||
| b ИЛИ с поправкой на возраст и пол. Логистическая регрессия. 95% ДИ. | |||||||
| c Распределены по частоте продаж. | |||||||
| Пенициллин широкого спектра действия (эталонный) | 13,947 | 1,8 | 1 | 4,3 | 1 | ||
| Пенициллин V | 10,737 | ,410,737 | ,45,3 | 1,3 (1,2–1,5) | |||
| Пенициллин V (собственный) c | |||||||
| Calcip10 | 91 | 1 | 4,8 | 1 | |||
| Роцилин | 1647 | 3,8 | 1,3 (1,0–1,8) | 6,4 | 1,4 (1,1–1,8) | ||
| 2,1 (1,6–2,7) | 4,8 | 1,0 (0,7–1,3) | |||||
| Аципен Солютаб | 1558 | 6,5 | 2,4 (1,8–3,0) | 5,1 | 1,1 (1,1 (1,8–3,0) .4) | ||
| Примциллин | 1132 | 7,6 | 2,7 (2,0–3,5) | 6,3 | 1,3 (1,0–1,8) | ||
| . | Повторите рецепт в течение 1-2 дней . | Повторите рецепт в течение 3–10 дней . | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Подгруппа антибиотиков . | Рецепты . | (%) a . | Прил. ОШ (95% ДИ) b . | (%) a . | Прил. ОШ (95% ДИ) b . | ||||||
| a Процент выписанных рецептов с последующим повторным назначением. | |||||||||||
| b ИЛИ с поправкой на возраст и пол. Логистическая регрессия. 95% ДИ. | |||||||||||
| c Распределены по частоте продаж. | |||||||||||
| Пенициллин широкого спектра действия (эталон) | 13,947 | 1.8 | 1 | 4,3 | 1 | ||||||
| Пенициллин V | 10,737 | 4,7 | 2,9 (2,5–3,4) | 5,3 | 1,3 (1,2–1,5) | собственный c | |||||
| Calcipen (справочный) | 4608 | 3,1 | 1 | 4,8 | 8 | 1,3 (1,0–1,8) | 6,4 | 1,4 (1,1–1,8) | |||
| Вепикомбин | 1641 | 6,1 | 2,1 (1,6–2,7) | 4,8 | 1,0 (0,7–1) | ||||||
| Аципен Солютаб | 1558 | 6,5 | 2,4 (1,8–3,0) | 5,1 | 1,1 (0,9–1,4) | ||||||
| Примциллин | 1132 | 6.3 | 1,3 (1,0–1,8) | ||||||||
Персонал Департамента медицинского страхования и профилактической медицины и больницы Регистратуры в графстве Северная Ютландия в основном благодарны за отличную помощь в подготовке данных к анализу. Исследование было поддержано The Medical Research. Unit, округ Рингкьёбинг, и Датским советом по медицинским исследованиям (грант No. 9700677). Деятельность Датского научного центра эпидемиологии финансируется за счет гранта. от Датского национального исследовательского фонда.
Список литературы
1.Санс, Э. Дж. (
1992
). Употребление наркотиков в дети, не госпитализированные.Pharmaceutisch Weekblad Scientific Edition
14
,1
–8. 2.Трейн, Н., Стеффенсен, Ф. Х., Мортенсен, Дж. Т., Шёнхейдер, Х. К. и Соренсен, Х. Т. (
1999
). А на основе населения изучение рецептов антибиотиков для датских детей.Детская инфекционная болезнь Журнал
18
,333
–7. 3.Макдональд, Т. М., Коллинз, Д., МакГилкрист, М. М., Стивенс Дж., МакКендрик А. Д., МакДевитт Д. Г. и др. . (
1995
). В использование и экономическая оценка антибиотиков, назначаемых в первичной медико-санитарной помощи.Журнал антимикробной химиотерапии
35
,191
–204. 4.Стеффенсен, Ф. Х., Шёнхейдер, Х. К., Мортенсен, Дж. Т., Нильсен, К. и Соренсен, Х. Т.(
1997
). Изменения в возмещение политика в отношении антибиотиков и схемы их назначения на практике.Клиническая микробиология и Инфекция
3
,653
–7. 5.Justesen, T., Korsager, B. & Scheibel, J. (1998). Вейледнинг и набор антибиотиков. In Lægeforeningens Medicinfortegnelse , 21st edn, (Альдершвиле, Дж., Хансен, М. С., Кампманн, Дж. П. и Вей-Хансен, Б., ред.), стр. 831–54.Lægeforeningens Forlag, Копенгаген.
6.Стил, Р. У., Эстрада, Б., Бег, Р. Э., Мирза, А., Травиллион Д. А. и Томас М. П. (
1997
). Двойное слепое сравнение вкусов из детские суспензии антибиотиков.Клиническая педиатрия
36
,193
–9. 7.Баухнер, Х. и Кляйн, Дж. О. (
1997
). Вопросы родителей при выборе противомикробных препаратов для младенцев и детей.Клинический Педиатрия
36
,201
–5. 8.Арасон, В. А., Кристинссон, К. Г., Сигурдссон, Дж. А., Стефансдоттир, Г., Мёльстад, С. и Гудмундссон, С. (
1996
). Делать противомикробные препараты увеличивают скорость носительства устойчивых к пенициллину пневмококков у детей? Поперечное исследование распространенности.Британский медицинский журнал
313
,387
–91. 9.Сеппала, Х., Клаукка, Т., Вуопио-Варкила, Дж., Муотиала, А., Хелениус, Х., Лагер, К. и др. . (
1997
). Эффект от изменения потребление макролидных антибиотиков при резистентности к эритромицину стрептококков группы А в Финляндия. Финская исследовательская группа по устойчивости к противомикробным препаратам.New England Journal of Медицина
337
,441
–6. 10.Payne, D. & McKenzie, S.А. (
1996
). Пероральные антибиотики при распространенных инфекциях у детей: за и против.Британский журнал Госпитальная медицина
56
,481
–5.Британское общество антимикробной химиотерапии
Цефалоспорины широкого спектра действия третьего поколения
Изображения: Ссылки по теме на внешние сайты (из Bing)
Онтология: Цефотаксим (C0007554)
| Определение (NCI) | Полусинтетический цефалоспориновый антибиотик третьего поколения с бактерицидной активностью.Цефотаксим подавляет синтез мукопептида, связываясь с пенициллин-связывающими белками и инактивируя их, тем самым препятствуя заключительной стадии транспептидации, необходимой для сшивания пептидогликановых единиц, которые являются компонентом стенок бактериальных клеток. Это приводит к снижению стабильности клеточной стенки и вызывает лизис клеток. |
| Определение (MSH) | Полусинтетический цефалоспорин широкого спектра действия. |
| Определение (PDQ) | Полусинтетический цефалоспориновый антибиотик третьего поколения с бактерицидной активностью. Цефотаксим подавляет синтез мукопептида, связываясь с пенициллин-связывающими белками и инактивируя их, тем самым препятствуя заключительной стадии транспептидации, необходимой для сшивания пептидогликановых единиц, которые являются компонентом стенок бактериальных клеток.Это приводит к снижению стабильности клеточной стенки и вызывает лизис клеток. Проверьте наличие активных клинических испытаний http://www.cancer.gov/Search/ClinicalTrialsLink.aspx?id=39177&idtype=1 или http://www.cancer.gov/Search/ClinicalTrialsLink.aspx?id=39177&idtype= 1 & closed = 1 «закрытых клинических испытаний с использованием этого агента. («http://nciterms.nci.nih.gov:80/NCIBrowser/ConceptReport.jsp?dictionary=NCI_Thesaurus&code=C354» Тезаурус NCI) |
| Концепции | Антибиотик ( T195 ) , Органические химические вещества ( T109 ) |
| МСХ | D002439 |
| SnomedCT | 3334000, 372704003 |
| LNC | LP14831-9, MTHU002074 |
| Английский | Цефотаксим, Цефотаксим, Цефотаксим, 5-тиа-1-азабицикло (4.2.0) окт-2-ен-2-карбоновая кислота, 3 — ((ацетилокси) метил) -7 — (((2-амино-4-тиазолил) (метоксиимино) ацетил) амино) -8-оксо-, мононатриевая соль , (6R- (6альфа, 7бета (Z))) -, цефотаксим (лекарство), цефотаксим [химическое вещество / ингредиент], цефотаксим, цефотаксим, ЦЕФОТАКСИМ, препарат цефотаксим, цефотаксим (продукт), цефотаксим (вещество) |
| Шведский | Цефотаксим |
| Чешский | цефотаксим |
| финский | Кефотаксиими |
| Русский | ЦЕФОТАКСИМ, ЦЕФОТАКСИМ |
| Японский | セ フ ォ タ キ シ ム |
| Хорватский | ЦЕФОТАКСИМ |
| Польский | Чефотаксым |
| Испанский | цефотаксима (продукт), цефотаксима (сустансия), цефотаксима, цефотаксима |
| Французский | Цефотаксим |
| Немецкий | Цефотаксим |
| Итальянский | Цефотаксима |
| Португальский | Цефотаксима |
Онтология: Цефтизоксим (C0007560)
| Определение (NCI) | Полусинтетический цефалоспорин третьего поколения широкого спектра действия, устойчивый к бета-лактамазам, обладающий антибактериальной активностью.Цефтизоксим связывается и инактивирует пенициллин-связывающие белки (PBP), расположенные на внутренней мембране стенки бактериальной клетки. PBP — это ферменты, участвующие в терминальных стадиях сборки бактериальной клеточной стенки и в изменении формы клеточной стенки во время роста и деления. Инактивация PBP препятствует сшиванию цепей пептидогликана, необходимых для прочности и жесткости бактериальной клеточной стенки. Это приводит к ослаблению стенки бактериальной клетки и вызывает лизис клеток. |
| Определение (MSH) | Полусинтетический цефалоспориновый антибиотик, который можно вводить внутривенно или в виде суппозиториев.Препарат обладает высокой устойчивостью к широкому спектру бета-лактамаз и активен в отношении широкого спектра как аэробных, так и анаэробных грамположительных и грамотрицательных организмов. Он имеет небольшое количество побочных эффектов и, как сообщается, безопасен и эффективен у пожилых пациентов и пациентов с гематологическими нарушениями. |
| Концепции | Антибиотик ( T195 ) , Органические химические вещества ( T109 ) |
| МСХ | D015296 |
| SnomedCT | 372770006, 54577009 |
| LNC | LP15253-5, MTHU004181 |
| Английский | Цефтизоксим, 5-тиа-1-азабицикло (4.2.0) окт-2-ен-2-карбоновая кислота, 7 — (((2-амино-4-тиазолил) (метоксиимино) ацетил) амино) -8-оксо-, (6R- (6альфа, 7бета (Z)) ) -, цефтизоксим [химическое вещество / ингредиент], цефтизоксим, цефтизоксим (продукт), цефтизоксим (вещество), цефизоксим |
| Шведский | Цефтизоксим |
| Чешский | цефтизоксим, цефподоксим проксетил |
| финский | Кефтицоксиими |
| Русский | ЦЕФТИЗОКСИМ, ЦЕФТИЗОКСИМ |
| Японский | セ フ チ ゾ キ シ ム ナ ト リ ウ ム, セ フ チ ゾ キ シ ム |
| Хорватский | ЦЕФТИЗОКСИМ |
| Польский | Цефтизоксым |
| Испанский | цефтизоксима (продукт), цефтизоксима (сустансия), цефтизоксима, цефтизоксима |
| Французский | Цефтизоксим |
| Немецкий | Цефтизоксим |
| Итальянский | Цефтизоксима |
| Португальский | Цефтизоксима |
Онтология: Роцефин (C0035750)
| Концепции | Антибиотик ( T195 ) , Органические химические вещества ( T109 ) |
| МСХ | D002443 |
| Английский | Роцефин, цефтриаксон (роцефин), роцефин, роцефин, марка цефтриаксона натрия Hoffman La Roche, марка цефтриаксона натрия Hoffman-La Roche, роцефалин, роцефин, марка Roche цефтриаксона натрия |
Онтология: цефподоксим (C0055011)
| Определение (NCI) | Полусинтетический цефалоспорин третьего поколения и бета-лактамный антибиотик с бактерицидной активностью.Эффект цефподоксима зависит от его связывания с пенициллин-связывающими белками (PBP), расположенными в цитоплазматической мембране бактерий. Связывание приводит к ингибированию ферментов транспептидазы, тем самым предотвращая сшивание пентаглицинового мостика с четвертым остатком пентапептида и прерывая последующий синтез пептидогликановых цепей. В результате цефподоксим подавляет образование бактериальной перегородки и синтеза клеточной стенки. |
| Концепции | Антибиотик ( T195 ) , Органические химические вещества ( T109 ) |
| МСХ | C053268 |
| SnomedCT | 387534007, 96049003 |
| LNC | LP15210-5, MTHU003033 |
| Английский | 5-тиа-1-азабицикло (4.2.0) окт-2-ен-2-карбоновая кислота, 7 — (((2-амино-4-тиазолил) (метоксиимино) ацетил) амино) -3- (метоксиметил) -8-оксо-, мононатриевая соль, (6R — (6альфа, 7бета (Z))) -, цефподоксим, цефподоксим, цефподоксим, цефподоксим (продукт), цефподоксим (вещество) |
| Испанский | цефподоксима (продукт), цефподоксима (сустансия), цефподоксима |
Онтология: Цефиксим (C0060400)
| Определение (NCI_NCI-GLOSS) | Антибиотик, применяемый для лечения инфекции.Он принадлежит к семейству препаратов, называемых цефалоспоринами. |
| Определение (NCI) | Цефалоспориновый антибиотик третьего поколения широкого спектра действия, полученный полусинтетическим путем из морского гриба Cephalosporium acremonium, с антибактериальной активностью. Как и пенициллин, бета-лактамный антибиотик цефиксим подавляет синтез клеточной стенки бактерий, нарушая синтез пептидогликана, что приводит к снижению стабильности бактериальной клеточной стенки и лизису бактериальных клеток.Стабильный в присутствии различных бета-лактамаз, этот агент более активен в отношении грамотрицательных бактерий и менее активен в отношении грамположительных бактерий по сравнению с цефалоспоринами второго поколения. |
| Определение (MSH) | Цефалоспориновый антибиотик третьего поколения, устойчивый к гидролизу бета-лактамазами. |
| Определение (PDQ) | Цефалоспориновый антибиотик третьего поколения широкого спектра действия, полученный полусинтетическим путем из морского гриба Cephalosporium acremonium, с антибактериальной активностью. Как и пенициллин, бета-лактамный антибиотик цефиксим подавляет синтез клеточной стенки бактерий, нарушая синтез пептидогликана, что приводит к снижению стабильности бактериальной клеточной стенки и лизису бактериальных клеток.Стабильный в присутствии различных бета-лактамаз, этот агент более активен в отношении грамотрицательных бактерий и менее активен в отношении грамположительных бактерий по сравнению с цефалоспоринами второго поколения. Проверьте наличие активных клинических испытаний http://www.cancer.gov/Search/ClinicalTrialsLink.aspx?id=37809&idtype=1 или http://www.cancer.gov/Search/ClinicalTrialsLink.aspx?id=37809&idtype= 1 & closed = 1 «закрытых клинических испытаний с использованием этого агента. («http://nciterms.nci.nih.gov:80/NCIBrowser/ConceptReport.jsp? dictionary = NCI_Thesaurus & code = C1100 «Тезаурус NCI) |
| Концепции | Антибиотик ( T195 ) , Органические химические вещества ( T109 ) |
| МСХ | D020682 |
| SnomedCT | 387536009, 96052006 |
| LNC | LP17701-1, MTHU005580 |
| Английский | цефиксим, цефиксим (лекарство), 5-тиа-1-азабицикло (4.2.0) окт-2-ен-2-карбоновая кислота, 7 — (((2-амино-4-тиазолил) ((карбоксиметокси) имино) ацетил) амино) 3-этенил-8-оксо-, тригидрат, (6R- ( 6альфа, 7бета (Z))) -, цефиксим [химическое вещество / ингредиент], цефиксим, тригидрат, цефиксим, тригидрат цефиксима, цефиксим (продукт), цефиксим (вещество), цефиксим |
| Шведский | Цефиксим |
| Чешский | цефиксим |
| финский | Кефиксиими |
| Русский | ЦЕФИКСИМ, ЦЕФИКСИМ |
| Японский | セ フ ィ キ シ ム |
| Польский | Чефиксым |
| Испанский | цефиксима (продукт), цефиксима (сустансия), цефиксима, цефиксима |
| Французский | Цефиксим |
| Немецкий | Цефиксим |
| Итальянский | Чефиксима |
| Португальский | Чефиксима |
Онтология: Клафоран (C0701052)
| Концепции | Антибиотик ( T195 ) , Органические химические вещества ( T109 ) |
| МСХ | D002439 |
| Английский | Клафоран ADD-Vantage, клафоран, Клафоран, Клафоран, торговая марка Aventis цефотаксима натрия, Aventis Pharma Brand of Cefotaxime Sodium, Hoechst Brand of Cefotaxime Sodium, Primafen |
Онтология: Вантин (C0724204)
| Концепции | Антибиотик ( T195 ) , Органические химические вещества ( T109 ) |
| МСХ | C053267 |
| Английский | Вантин, Вантин |
цефалоспоринов | Американская академия педиатрии
Цели
После завершения этой статьи читатели должны иметь возможность:
Описать механизм действия цефалоспоринов.
Выделите два наиболее распространенных механизма устойчивости к пенициллинам.
Обсудите наиболее частые побочные эффекты обычных цефалоспоринов.
Укажите, какие цефалоспорины обладают активностью против Pseudomonas.
Введение
Цефалоспорины — это бета-лактамные противомикробные препараты, которые имеют общие механизмы действия и аналогичную структуру с пенициллинами (рис. 1). Пенициллины и цефалоспорины имеют одно и то же четырехчленное «основное» бета-лактамное кольцо, но цефалоспорины имеют дополнительный атом в боковом кольце.Модифицированные боковые цепи на любом из колец изменяют антимикробную активность, устойчивость к бета-лактамазам или фармакокинетику. Чувствительные к пенициллину патогены обычно чувствительны к цефалоспорину. Исключение составляют Listeria и Pasteurella sp. Цефалоспорины обладают активностью против распространенных грамотрицательных микроорганизмов, таких как Escherichia coli , нетипируемых Haemophilus influenzae (ntHi) и чувствительных к метициллину Staphylococcus aureus (MSSA), но все устойчивы к метициллину RS энтерококки устойчивы к цефалоспоринам.Из-за минимального использования или отсутствия в настоящее время мы не будем обсуждать цефалотин, моксалактам, цефамандол, цефоницид, цефоранид, цефтизоксим, цефоперазон, цефпиром, цефметазол или цефотетан.
Рисунок.Цефалоспорин в сравнении с кольцевыми структурами пенициллина. Сплошные стрелки указывают на центральное четырехчленное бета-лактамное кольцо как в пенициллинах, так и в цефалоспоринах. Открытые стрелки указывают на пяти- и шестичленные боковые кольца для пенициллинов и цефалоспоринов соответственно.R указывает на дополнительные участки боковой цепи, в которых замены различных химических групп приводят к разным антимикробным спектрам, фармакокинетике или устойчивости к бета-лактамазам.
Механизм действия
Чтобы понять механизм действия цефалоспоринов, жесткие стенки бактериальных клеток можно рассматривать как серию повторяющихся взаимосвязанных единиц, напоминающих напольную плитку. Во время репликации бактерия удаляет «плитки» по окружности, чтобы позволить клеткам делиться посредством действия, похожего на защемление, при этом быстро помещая новые «плитки» на концах того, что стало двумя бактериями.Этот процесс требует, чтобы ферменты блокировали заменяемые плитки. Такие ферменты являются мишенями для бета-лактамных антибиотиков и называются пенициллин-связывающими белками (PBP). Действие антибиотика требует связывания с PBP, предотвращая их закрытие…
Необходимость улучшить доступность антибиотиков «группы доступа» и сократить использование антибиотиков «группы наблюдения» в Индии для оптимального использования антибиотиков для сдерживания устойчивости к противомикробным препаратам | Журнал фармацевтической политики и практики
Устойчивость к противомикробным препаратам : Преодоление кризиса для здоровья и богатства наций , отчет Джим О’Нил, 2014 г.
Шарланд М., Пульчини С., Харбарт С., Зенг М., Гандра С., Матур S, Magrini N. Классифицировать антибиотики в списке основных лекарственных средств ВОЗ для оптимального использования — будьте осторожны. Lancet Infect Dis. 2018; 18 (1): 18–20.
Артикул Google Scholar
МакГеттиган П., Родерик П., Кадам А., Поллок А.М.Доступ, наблюдение и резервирование антибиотиков в Индии: вызовы для руководства ВОЗ. Ланцет Glob Health. 2017; 5 (11): e1075–6.
Артикул Google Scholar
Klein EY, Van Boeckel TP, Martinez EM, Pant S, Gandra S, Levin SA, Goossens H, Laxminarayan R. Глобальный рост и географическая конвергенция потребления антибиотиков в период с 2000 по 2015 гг. Proc Natl Acad Sci. 2018: 201717295.
Хсиа Ю., Шарланд М., Джексон К., Вонг И.С., Магрини Н., Белики Дж.Потребление пероральных составов антибиотиков для детей младшего возраста в соответствии с группами антибиотиков ВОЗ по доступу, слежению, резервированию (AWaRe): анализ данных о продажах из 70 стран со средним и высоким доходом. Lancet Infect Dis. 2019; 19 (1): 67–75.
Артикул Google Scholar
Гандра С., Джоши Дж., Третт А., Санкхил Л. Обзорный отчет по устойчивости к противомикробным препаратам в Индии. Вашингтон, округ Колумбия: Центр экономики и политики по динамике заболеваний; 2017 г.
Google Scholar
Патерсон Д.Л., Бономо РА. Β-лактамазы расширенного спектра: клинические обновления. Clin Microbiol Rev.2005; 18 (4): 657–86.
CAS Статья Google Scholar
Calbo E, Romaní V, Xercavins M, Gómez L, Vidal CG, Quintana S, Vila J, Garau J. Факторы риска развития внебольничных инфекций мочевыводящих путей, вызванных Escherichia coli, несущей β-лактамазы расширенного спектра действия .J Antimicrob Chemother. 2006. 57 (4): 780–3.
CAS Статья Google Scholar
Gandra S, Mojica N, Klein EY, Ashok A, Nerurkar V, Kumari M, Ramesh U, Dey S, Vadwai V, Das BR. Тенденции устойчивости к антибиотикам среди основных бактериальных патогенов, выделенных из культур крови, протестированных в большой сети частных лабораторий в Индии, 2008–2014 гг. Int J Infect Dis. 2016; 50: 75–82.
Артикул Google Scholar
Котвани А., Холлоуэй К., Чаудхури Р. Методология наблюдения за использованием противомикробных препаратов среди амбулаторных пациентов в Дели. Индийский J Med Res. 2009; 129 (5): 555.
PubMed Google Scholar
Котвани А., Холлоуэй К. Тенденции использования антибиотиков среди амбулаторных пациентов в Нью-Дели, Индия. BMC Infect Dis. 2011; 11 (1): 99.
Артикул Google Scholar
Организация WH: выбор и использование основных лекарственных средств: отчет экспертного комитета ВОЗ, 2017 г. (включая 20-й типовой список основных лекарственных средств ВОЗ и 6-й типовой список основных лекарственных средств для детей): Всемирная организация здравоохранения ; 2017 г.
Котвани А., Холлоуэй К. Практика назначения антибиотиков при острых неосложненных инфекциях дыхательных путей в учреждениях первичной медико-санитарной помощи в Нью-Дели, Индия. Tropical Med Int Health. 2014; 19 (7): 761–8.
Артикул Google Scholar
Котвани А., Джоши П., Джамб У, Холлоуэй К. Восприятие врача, назначившего лекарство, и фармацевтов об использовании антибиотиков при острой неосложненной диарее у детей и инфекции верхних дыхательных путей в Нью-Дели: качественное исследование.Индийский J Pharmacol. 2017; 49 (6): 419.
Артикул Google Scholar
Котвани А., Кумар С., Суэйн П.К., Сури Дж., Гаур С. Схемы назначения противомикробных препаратов при внебольничной пневмонии у госпитализированных пациентов: ретроспективное пилотное исследование из Нью-Дели, Индия. Индийский J Pharmacol. 2015; 47 (4): 375.
CAS Статья Google Scholar
Гандра С., Сингх С.К., Джинка Д.Р., Канити Р., Чиккаппа А.К., Шарма А., Дхармапалан Д., Васудеван А.К., Тунга О, Акула А.Обследования точечной распространенности использования противомикробных препаратов среди госпитализированных детей в шести больницах Индии в 2016 году. Антибиотики. 2017; 6 (3): 19.
Артикул Google Scholar
Torumkuney D, Chaiwarith R, Reechaipichitkul W., Malatham K, Chareonphaibul V, Rodrigues C, Chitins D, Dias M, Anandan S, Kanakapura S. Результаты исследования устойчивости к антибиотикам (SOAR) 2012–14 гг. Таиланд, Индия, Южная Корея и Сингапур. J Antimicrob Chemother.2016; 71 (Suppl_1): i3 – i19.
Артикул Google Scholar
Национальный центр контроля заболеваний. Национальные рекомендации по лечению противомикробных препаратов при инфекционных заболеваниях; 2016.
Арора Н.К. Рациональное использование антибиотиков при пневмонии. Indian Pediatr. 2010. 47 (1): 11–8.
Артикул Google Scholar
Индийский совет медицинских исследований.Руководство по лечению антимикробных препаратов при распространенных синдромах, 2017.
Anandan S, Sethuvel DPM, Gajendiren R, Verghese VP, Walia K, Veeraraghavan B. Молекулярная характеристика устойчивости к противомикробным препаратам клинических изолятов шигелл в 2014 и 2015 годах: тенденции в Южной Индии. Микробы. 2017; 7 (3): 115.
CAS Статья Google Scholar
Mukherjee P., Ramamurthy T., Bhattacharya MK, Rajendran K, Mukhopadhyay AK.Campylobacter jejuni у госпитализированных пациентов с диареей, Калькутта, Индия. Emerg Infect Dis. 2013; 19 (7): 1155.
Артикул Google Scholar
Котвани А., Холлоуэй К. Доступ к антибиотикам в Нью-Дели, Индия: значение для политики в отношении антибиотиков. J Pharm Policy Prac. 2013; 6 (1): 6.
Артикул Google Scholar
Антибиотикотерапия в стоматологии
Кариес зубов, некроз пульпы, травмы и заболевания пародонта могут привести к зубным инфекциям, которые могут иметь серьезные последствия, поражающие как мягкие, так и твердые ткани полости рта.Стоматологические инфекции обычно проявляются симптомами боли, лихорадки и отека. Хирургическое и эндодонтическое лечение — это раннее лечение инфицированных зубов с последующей антибактериальной терапией. Существуют также некоторые альтернативные методы лечения инфекции, такие как низкоинтенсивная лазерная терапия и фотодинамическая терапия. Антибиотики обычно используются в стоматологических процедурах для лечения одонтогенных инфекций, недонтогенных инфекций, местной инфекции, очаговой инфекции и профилактики. Антибиотикопрофилактика назначается пациентам с иммуносупрессивными состояниями, инфекционным эндокардитом, нарушением обмена веществ, а также пациентам с протезами суставов.Чтобы уменьшить осложнения из-за ненужного назначения антибиотиков, особенно устойчивости к бактериям, необходимо разработать подробные рекомендации. Было отмечено, что только около 12% стоматологов адекватно и правильно назначают антибиотики, что свидетельствует о важности всеобъемлющих рекомендаций. Назначение антибиотиков может вызвать некоторые побочные эффекты, такие как реакции гиперчувствительности, дерматологические и аллергические расстройства. Кроме того, ненужное назначение антибиотиков может привести к ряду серьезных последствий, например, к бактериальной резистентности, желудочным и гематологическим проблемам, а также к отвлечению бактериальной микробиоты.В настоящем обзоре делается попытка обобщить показания к антибактериальной терапии в стоматологии и обсудить общие типы антибиотиков, которые обычно используются в стоматологической практике, на основе фармакологических классов. Кроме того, рассматриваются типы антибиотиков, которые считаются безопасными во время беременности и детства.
1. Предпосылки
Орофациальные инфекции обычно подразделяются на одонтогенные и неодонтогенные. Заболевания, возникающие в зубах и опорных структурах зубов, называются одонтогенными инфекциями.С другой стороны, структуры зубов не вовлечены в недонтогенные инфекции [1, 2]. Кариес зубов, некроз пульпы, травмы зубов и заболевания пародонта могут привести к зубным инфекциям, которые могут иметь серьезные последствия, затрагивающие как мягкие, так и твердые ткани полости рта. Согласно предыдущему исследованию, грамположительные кокки ответственны за около 65% орофациальных инфекций, а грамотрицательные бациллы могут быть обнаружены в 25% образцов ротовой полости пациентов [3]. Орофациальные инфекции чаще всего возникают в возрасте 21–40 лет; кроме того, распространенность заболевания не связана с полом [1, 4].
Стоматологические инфекции обычно проявляются симптомами боли и отека в области ротовой полости. Эти инфекции следует лечить как можно скорее, поскольку они могут привести к тяжелым и непоправимым последствиям, таким как остеомиелит, абсцесс мозга, обструкция дыхательных путей, инфекция сонных артерий, синусит, сепсис, менингит, тромбоз кавернозного синуса, абсцесс орбиты и потеря зрения [ 5]. Было отмечено, что наиболее частым превалирующим признаком орофациальных инфекций являются зубочелюстные абсцессы [3].
Зубные инфекции можно вылечить с помощью хирургических вмешательств, эндодонтического лечения и назначения антибиотиков [4]. Необходимо провести раннее хирургическое лечение инфицированного зуба, чтобы предотвратить дальнейшие последствия; в тяжелых случаях это может включать санацию, ирригацию, разрез и дренаж (I&D) [6]. Кроме того, пациентам с признаками системного поражения предлагается внутривенное введение антибиотиков в соответствии с бактериальными культурами и чувствительностью [5, 7].Настоящие руководящие принципы указывают, что антибиотики следует назначать после устранения источников инфекции. Их следует назначать на 2-3 дня подряд после хирургического вмешательства. Было обнаружено, что более длительная антибактериальная терапия не приносит значительных результатов и не рекомендуется [8]. Это может привести к ненужному назначению и увеличению продолжительности антибактериальной терапии, что может иметь серьезные последствия [9].
Предыдущие исследования показали, что около 12% стоматологов адекватно назначают антибиотики в качестве профилактического вмешательства и лечения [7].В связи с этим в предыдущих отчетах упоминалось, что наиболее распространенным антибиотиком, назначаемым в стоматологической практике, является амоксициллин, за которым следуют амоксициллин и клавулановая кислота (таблица 1) [10]. Назначение антибиотиков может вызвать некоторые побочные эффекты, такие как реакции гиперчувствительности, дерматологические и аллергические расстройства [11]. Кроме того, ненужное назначение антибиотиков может привести к ряду серьезных жалоб, например, на устойчивость к бактериям, желудочные и гематологические проблемы, а также утечку бактериальной микробиоты [12, 13].Кроме того, это может привести к резистентности бактерий в полости рта, что также вызывает растущую озабоченность в стоматологии и медицине. Чтобы предотвратить эти проблемы, следует назначать антибиотики узкого спектра и ограничиваться острыми инфекциями. Более того, необходимо проводить дополнительное обучение и исследования, чтобы предотвратить и уменьшить проблему устойчивости к антибиотикам [14].
| ||||||||||||||||||||||||||||||||||
В этом обзоре мы стремимся предоставить стоматологам некоторые применимые данные для назначения соответствующих типов антибиотиков. Сначала упоминаются распространенные виды антибиотиков, которые считаются безопасными при беременности и детстве.Затем рассматриваются распространенные случаи, когда требуется терапия или профилактика антибиотиками, а также наиболее полезные и часто используемые антибиотики в стоматологии (рис. 1).
2. Показания к применению антибиотиков
Антибиотики рекомендуются в случаях профилактики местных и очаговых инфекций, а также для лечения одонтогенных и недонтогенных инфекций [13, 15]. Антибиотики показаны не при всех одонтогенных инфекциях; их не следует использовать вместо устранения источника инфекции [16].В случае инфекции рекомендуется I&D, хирургическая обработка раны и эндодонтическое лечение с последующей системной антибактериальной терапией [17]. Более того, практикующие врачи также должны помнить, что антибиотикопрофилактика показана при определенных условиях [18]. На рисунке 2 представлены показания к применению антибиотиков в стоматологической практике.
Антибиотикопрофилактика является необходимой опцией для пациентов с ослабленным иммунитетом, пациентов с онкологическими заболеваниями в анамнезе, лиц с инфекционным эндокардитом, пациентов с метаболическими нарушениями (такими как диабет и спленэктомия), пациентов с протезами суставов, домашних катетеров, нейрохирургические шунты, пороки сердца, хирургические легочные шунты, гипертрофическая кардиомиопатия, пролапс митрального клапана и протезы клапанов сердца [19, 20].У восприимчивых пациентов некоторые процедуры повышают риск инфекции, такие как удаление зубов, хирургические периодонтальные процедуры, установка зубных имплантатов, реимплантация зубов, эндодонтические процедуры или эндодонтические операции, поддесневое размещение волокон или полосок антибиотиков и интралигаментарные местные анестетики [19] . Профилактика для здоровых пациентов также предлагается в специальной стоматологической практике, такой как хирургия доброкачественных опухолей, костная пластика, установка имплантата, периапикальная хирургия и удаление ретинированных зубов [20].
Назначение антибиотиков рекомендуется при острых инфекционных состояниях, таких как некротический язвенный гингивит, периодонтит III степени C / резцово-молярного типа (ранее называвшийся локализованным агрессивным пародонтитом), острый периапикальный абсцесс, целлюлит, местное или системное распространение инфекции в пародонтальный абсцесс, перикоронит, периимплантит, инфицирование глубоких фасциальных слоев головы и шеи, а также при лихорадке и / или недомогании [6, 20, 21].
3.Использование антибиотиков в детской стоматологии
При назначении антибиотиков следует учитывать анатомические и физиологические различия между детьми и взрослыми, такие как количество воды и жира в их организме, созревание иммунной системы, объем белка и уровень ферментов печени. для детей [22]. Стоматологи лечат детей антибиотиками, чтобы снизить риск бактериемии, вызванной стоматологическими инфекциями; однако антибиотикотерапия не должна использоваться в качестве альтернативного метода устранения источника инфекции [23].Более того, устойчивость к антибиотикам из-за неправильного использования, назначения антибиотиков детям в неправильной ситуации и в течение слишком длительного периода времени является глобальной проблемой [24]. Поэтому практикующие стоматологи должны знать о правильном выборе антибиотиков и показаниях к антибактериальной терапии для детей младше 13 лет [24]. Общие типы и формы антимикробных препаратов, используемых в детской стоматологии, перечислены в таблицах 2 и 3.
| ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Ceftazidime-Avibactam (Avycaz): For the Treatment of Complicated Intra-Abdominal and Urinary Tract Infections. P T. 2016; 41 (8):4 79–83. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4959616/
Ceftazidime-Avibactam (Avycaz): For the Treatment of Complicated Intra-Abdominal and Urinary Tract Infections. P T. 2016; 41 (8):4 79–83. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4959616/ Can J Infect Dis Med Microbiol. 2015; 26 (6): 305–12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4692299/
Can J Infect Dis Med Microbiol. 2015; 26 (6): 305–12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4692299/ Dalbavancin: A Novel Lipoglycopeptide Antibiotic with Extended Activity Against Gram-Positive Infections. Infect Dis Ther. 2015; 4 (3): 245–58. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4575294/
Dalbavancin: A Novel Lipoglycopeptide Antibiotic with Extended Activity Against Gram-Positive Infections. Infect Dis Ther. 2015; 4 (3): 245–58. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4575294/ ..
..
 Без наличия каких-то симптомов и осложнений рекомендовать азитромицин (полусинтетический антибиотик широкого спектра действия — ред.) тоже не следует, потому что будет привыкание, а потом, когда действительно понадобится делать азитромицин, он уже не будет работать. Поэтому в домашних условиях нужно лечение, которое повышает иммунитет, и, возможно, какое-то легкое противовирусное профилактическое лечение…», — заявлял он.
Без наличия каких-то симптомов и осложнений рекомендовать азитромицин (полусинтетический антибиотик широкого спектра действия — ред.) тоже не следует, потому что будет привыкание, а потом, когда действительно понадобится делать азитромицин, он уже не будет работать. Поэтому в домашних условиях нужно лечение, которое повышает иммунитет, и, возможно, какое-то легкое противовирусное профилактическое лечение…», — заявлял он.